1. 引言:无声的健康危机
睡眠是维持生命体基本功能、促进身心健康与认知效能的关键生理过程。然而,在全球范围内,各类睡眠障碍日益普遍,成为影响数亿人口的无声健康危机,对个体健康、社会生产力乃至公共安全构成严重挑战。本文旨在基于最新的科学研究与临床进展,深入剖析睡眠障碍的多元成因、主要临床表现、科学诊断方法、前沿治疗策略,并对未来的发展方向进行展望。
2. 睡眠障碍的多元成因:复杂交织的网络
睡眠障碍的发生并非单一因素所致,往往是生理、心理、环境、行为、年龄及遗传等多重因素复杂交织作用的结果。
生理与疾病因素 呼吸系统疾病,尤其是阻塞性睡眠呼吸暂停(OSA),是导致夜间睡眠片段化和白天嗜睡的首要病因,常与失眠共存形成 COMISA 。多种神经系统异常也直接影响睡眠,例如发作性睡病与下丘脑分泌素(orexin)系统的功能障碍密切相关,表现为日间过度嗜睡和猝倒。
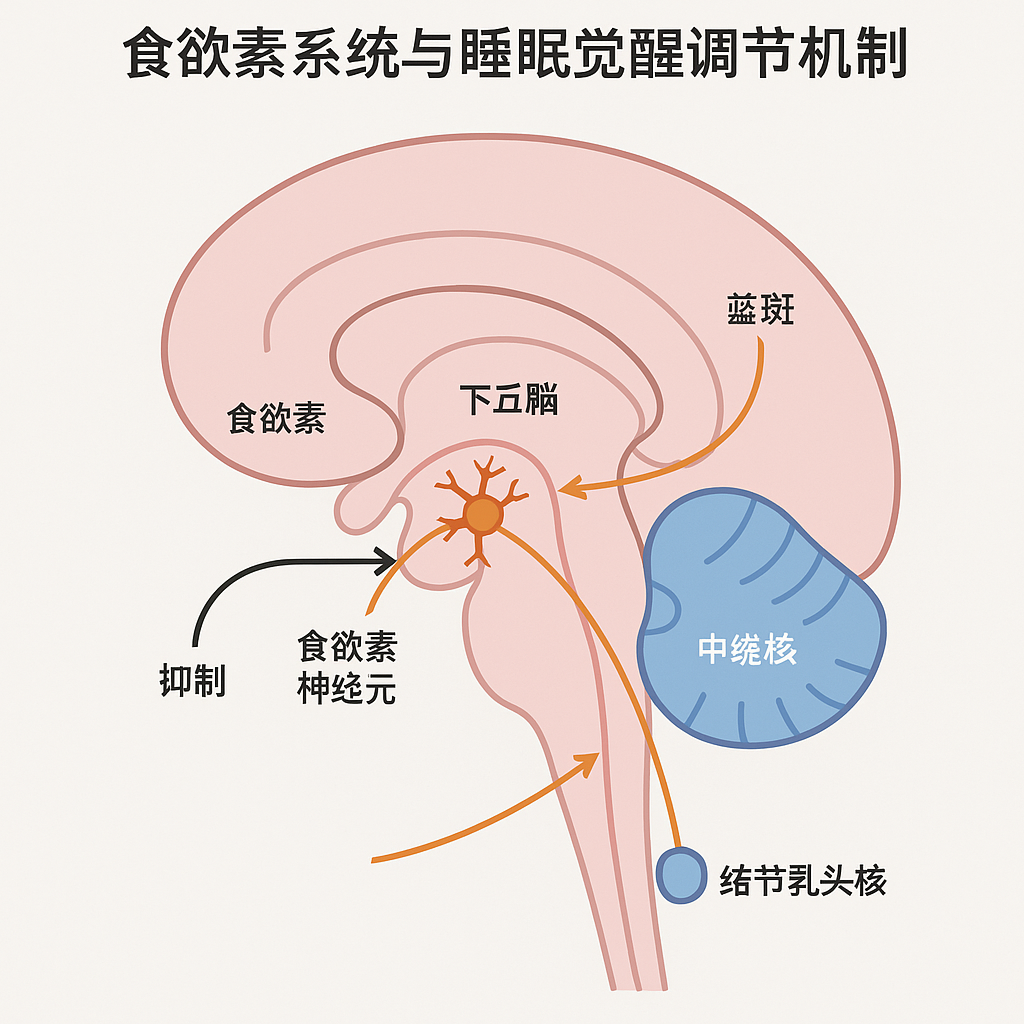 如图所示,食欲素(orexin)神经元位于下丘脑,其投射广泛,通过调控觉醒中枢维持清醒状态。食欲素信号的异常或缺乏可导致觉醒系统失调,进而引发嗜睡症等睡眠障碍。此外,不宁腿综合征(RLS)、内分泌变化(如更年期激素波动、甲状腺功能异常)、慢性躯体疾病(如心血管病、糖尿病、慢性疼痛)等均可显著干扰正常的睡眠结构和节律。 前沿研究正积极探索生物标志物在睡眠障碍病因机制中的作用。例如,血液或脑脊液中的免疫炎症相关因子(如白细胞介素 IL-6、C反应蛋白 CRP)被持续证实与失眠等睡眠障碍存在关联 [5]。基因表达层面,如 GABA 受体亚单位的表达变化,也被探索作为失眠的潜在血液标志物 [5]。然而,这些生物标志物的临床转化仍处于早期阶段,尚需更多研究验证其特异性和实用性 [5]。
如图所示,食欲素(orexin)神经元位于下丘脑,其投射广泛,通过调控觉醒中枢维持清醒状态。食欲素信号的异常或缺乏可导致觉醒系统失调,进而引发嗜睡症等睡眠障碍。此外,不宁腿综合征(RLS)、内分泌变化(如更年期激素波动、甲状腺功能异常)、慢性躯体疾病(如心血管病、糖尿病、慢性疼痛)等均可显著干扰正常的睡眠结构和节律。 前沿研究正积极探索生物标志物在睡眠障碍病因机制中的作用。例如,血液或脑脊液中的免疫炎症相关因子(如白细胞介素 IL-6、C反应蛋白 CRP)被持续证实与失眠等睡眠障碍存在关联 [5]。基因表达层面,如 GABA 受体亚单位的表达变化,也被探索作为失眠的潜在血液标志物 [5]。然而,这些生物标志物的临床转化仍处于早期阶段,尚需更多研究验证其特异性和实用性 [5]。心理与精神因素压力、焦虑和抑郁是导致失眠的核心驱动因素,失眠与这些情绪障碍之间存在高共病率和相互促进的关系。急性或慢性的应激事件亦可诱发不同程度的睡眠问题。
环境与行为因素 不良的睡眠环境(噪音、光照、温度不适)以及不健康的睡眠习惯(不规律作息、睡前使用电子设备产生的蓝光影响褪黑素分泌、睡前摄入咖啡因/酒精、白天过度小睡)是常见的促发或维持睡眠障碍的因素。多种药物也具有促失眠或促嗜睡的副作用,需在评估时充分考虑。
年龄与遗传因素年龄相关的睡眠结构变化(如老年人深度睡眠减少、夜间觉醒增多)使得老年人更容易出现睡眠障碍。某些睡眠障碍(如发作性睡病)具有明显的遗传易感性,家族史是重要的风险因素 [5]。
3. 主要现象与深远影响:不止是“睡不着”
睡眠障碍的表现形式多样,远不止“睡不着”或“睡不醒”,其对身心健康的负面影响深远。
常见睡眠障碍的临床表现
- 失眠症(Insomnia):表现为持续的入睡困难、睡眠维持障碍(夜醒频繁)或早醒,即使有充足的睡眠机会,并伴随日间功能损害(如疲劳、注意力不集中、情绪波动)。
- 睡眠呼吸暂停(Sleep Apnea):特征性表现为夜间响亮且不规律的打鼾、呼吸暂停、喘息或憋醒,白天常伴有过度嗜睡(Epworth嗜睡量表 ESS ≥10分)、疲劳、头痛等,生理监测中常表现出心率变异性(HRV)异常等信号改变 [5]。
- 嗜睡症(Hypersomnia):包括发作性睡病(日间无法控制的过度嗜睡、猝倒、睡眠麻痹、睡眠幻觉)和特发性嗜睡,严重影响日间功能。
- 其他类型:还包括昼夜节律睡眠-觉醒障碍(如轮班工作睡眠障碍、时差综合征)、异态睡眠(如梦游、夜惊、快速眼动睡眠行为障碍 RBD)等。
对身心健康的深远影响 长期睡眠障碍显著增加多种慢性疾病的风险,包括心血管疾病、糖尿病、肥胖和免疫功能下降。研究揭示,长期睡眠障碍与慢性低度炎症状态之间存在稳定联系 [5]。在心理层面,睡眠障碍会加重焦虑、抑郁等情绪障碍,并导致认知功能(注意力、记忆力、执行功能)下降。
对社会功能的影响 日间疲劳和认知障碍直接导致工作/学习效率降低,意外事故风险增加(如驾驶事故),并可能引发人际关系紧张。
4. 科学的诊断与评估:多维度的探查
对睡眠障碍的准确诊断依赖于多维度、多工具的综合评估。
- 临床问诊与病史采集:详细询问睡眠症状的性质、频率、病程、严重程度,以及潜在的诱因、共病史、用药史及家族史是诊断的第一步。
- 标准化量表评估:使用失眠严重指数(ISI)、匹兹堡睡眠质量指数(PSQI)量化失眠严重度,使用Epworth嗜睡量表(ESS)评估日间嗜睡程度,这些量表有助于量化日间功能损害并追踪疗效。
- 睡眠日记:要求患者连续记录至少两周的睡眠时间和质量、夜间觉醒次数、白天小睡等信息,是评估睡眠模式、计算睡眠效率和识别行为相关干扰因素的简便有效工具。
- 多导睡眠图(PSG):作为睡眠障碍诊断的金标准,PSG需要在专业睡眠实验室环境或居家进行,监测脑电、眼电、肌电、呼吸、血氧饱和度、心电图等多种生理信号,用于确诊OSA、周期性肢体运动障碍(PLMS)、异态睡眠(需同步视频脑电图鉴别与癫痫)等复杂睡眠障碍。
- 便携式睡眠监测(HST): 最新进展显著提升了HST设备的性能。硬件实现微型化,传感器更加多样化且舒适性增强,包括前额/耳道无线干电极用于 EEG 采集、柔性贴片式 ECG 装置、耳道/指环/腕部 PPG 用于 HR 和 SpO2 监测、基于应变传感器的呼吸监测以及多轴加速度计/陀螺仪用于运动检测和睡姿识别 [1]。这些设备可在居家自然环境下进行连续睡眠数据采集,优势在于舒适、便捷 [1]。 HST主要用于OSA的筛查与诊断,其结合深度学习算法实现自动睡眠分期的准确性已取得重要进展,Cohen’s κ 系数可达0.61至0.81,显示与人工评分有较高一致性 [1, 6]。AI的应用还推动了睡眠质量指标的自动化计算 [6]。尽管如此,便携设备的信号质量和抗干扰能力仍有提升空间,且 AI 算法的鲁棒性需面对 N1 期等困难分类阶段的挑战 [1]。
- 实验室检查:必要的血液检查有助于排除甲状腺功能异常、贫血等可能影响睡眠的潜在躯体病因。
- 特殊检查:多相睡眠潜伏期试验(MSLT)用于客观评估日间嗜睡程度,是诊断嗜睡症的核心检查。视频脑电图用于在睡眠期间记录脑电活动并同步录像,有助于鉴别异态睡眠与夜间癫痫发作。
5. 前沿的治疗与干预策略:通向高质量睡眠的新路径
睡眠障碍的治疗强调个体化和多模式整合,结合了药物、物理、心理行为及新兴技术等多种手段。
药物治疗:精准靶向与新型药物 药物治疗通常作为非药物治疗的补充,尤其适用于急性失眠或非药物治疗效果不佳的慢性失眠。治疗原则强调个体化、按需、短期使用,慢性失眠长期用药需定期评估。 近年来,双食欲素受体拮抗剂(DORA)作为新型药物展现出巨大潜力。其机制独特,通过阻断食欲素与受体结合,抑制过度活跃的觉醒系统,从而促进自然入睡。 以Daridorexant 50mg为代表的DORA药物,多项高质量研究(包括一项为期1年的长期研究)证实了其良好的长期安全性与耐受性 [4]。研究显示,其不良事件多为轻度且呈剂量依赖性(如鼻咽炎、头痛),未见明显药物依赖、耐药性、停药反跳或戒断症状 [4]。在疗效方面, Daridorexant 50mg显著改善了总睡眠时间(sTST)、睡后觉醒时间(WASO)等睡眠指标,并持续改善白天功能(通过 IDSIQ 量表评估),且改善幅度在一年内无减退趋势 [4]。网络 Meta 分析亦支持 DORA 类药物的整体安全有效性,并指出达立多雷生 50mg 在改善多项指标中表现优良 [4]。DORA 的优势在于其作用于觉醒系统的独特机制,不易引起传统镇静催眠药可能导致的晨间嗜睡等中枢抑制副作用 [4]。
物理治疗:神经调控的潜能重复经颅磁刺激(rTMS)是一种非侵入性神经调控技术,通过在头皮上方产生磁脉冲,调节特定脑区(如与情绪、认知和睡眠调控相关的左侧背外侧前额叶皮层 DLPFC)的神经活动和可塑性 [2]。
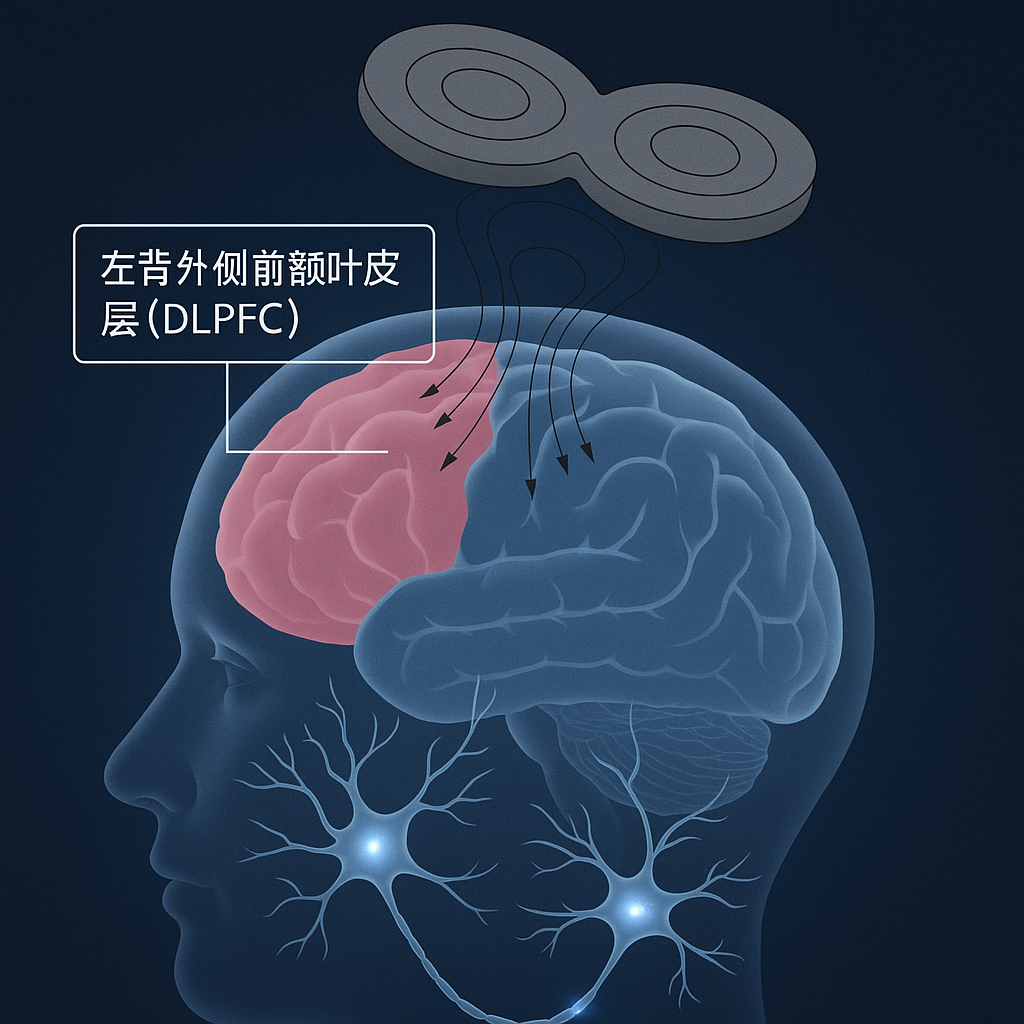 如图所示,rTMS 线圈放置于头部,产生磁场穿透颅骨并在特定脑区(DLPFC)诱发电流,影响神经元活动。研究显示,rTMS可改善慢性失眠患者的睡眠质量和认知功能 [2]。可能的机制包括增强脑淋巴清除功能(有助于清除代谢废物)、调节异常的脑功能连接和脑电活动等 [2]。然而,rTMS治疗失眠的参数(刺激位点、频率、强度)尚未完全标准化,仍需更多高质量的随机对照研究验证其长期疗效和优化治疗方案 [2]。其他神经调控技术如经颅电刺激(tES)和经皮耳迷走神经刺激(taVNS)在失眠治疗中也显示出初步潜力 [2]。光照疗法则是针对昼夜节律紊乱的重要物理干预手段。
如图所示,rTMS 线圈放置于头部,产生磁场穿透颅骨并在特定脑区(DLPFC)诱发电流,影响神经元活动。研究显示,rTMS可改善慢性失眠患者的睡眠质量和认知功能 [2]。可能的机制包括增强脑淋巴清除功能(有助于清除代谢废物)、调节异常的脑功能连接和脑电活动等 [2]。然而,rTMS治疗失眠的参数(刺激位点、频率、强度)尚未完全标准化,仍需更多高质量的随机对照研究验证其长期疗效和优化治疗方案 [2]。其他神经调控技术如经颅电刺激(tES)和经皮耳迷走神经刺激(taVNS)在失眠治疗中也显示出初步潜力 [2]。光照疗法则是针对昼夜节律紊乱的重要物理干预手段。心理行为疗法:核心基石与数字化革新认知行为疗法(CBT-I)是治疗慢性失眠的一线非药物治疗方案,其核心在于纠正导致失眠的错误认知和不良行为。CBT-I通常包括:睡眠限制(减少卧床时间以提高睡眠效率)、刺激控制(仅在有睡意时上床,避免在床上进行非睡眠活动)、认知重建(识别并挑战关于睡眠的负面或不合理信念)、放松训练以及睡眠卫生教育。 基于CBT-I原理,数字化认知行为疗法(dCBT-I)应运而生。通过智能手机应用程序、网页平台等数字媒介提供标准化或个性化的干预内容,dCBT-I具有便捷、可及性高、成本效益好的优势,且疗效已被证实可媲美面对面CBT-I,效果可持续达一年以上 [3]。
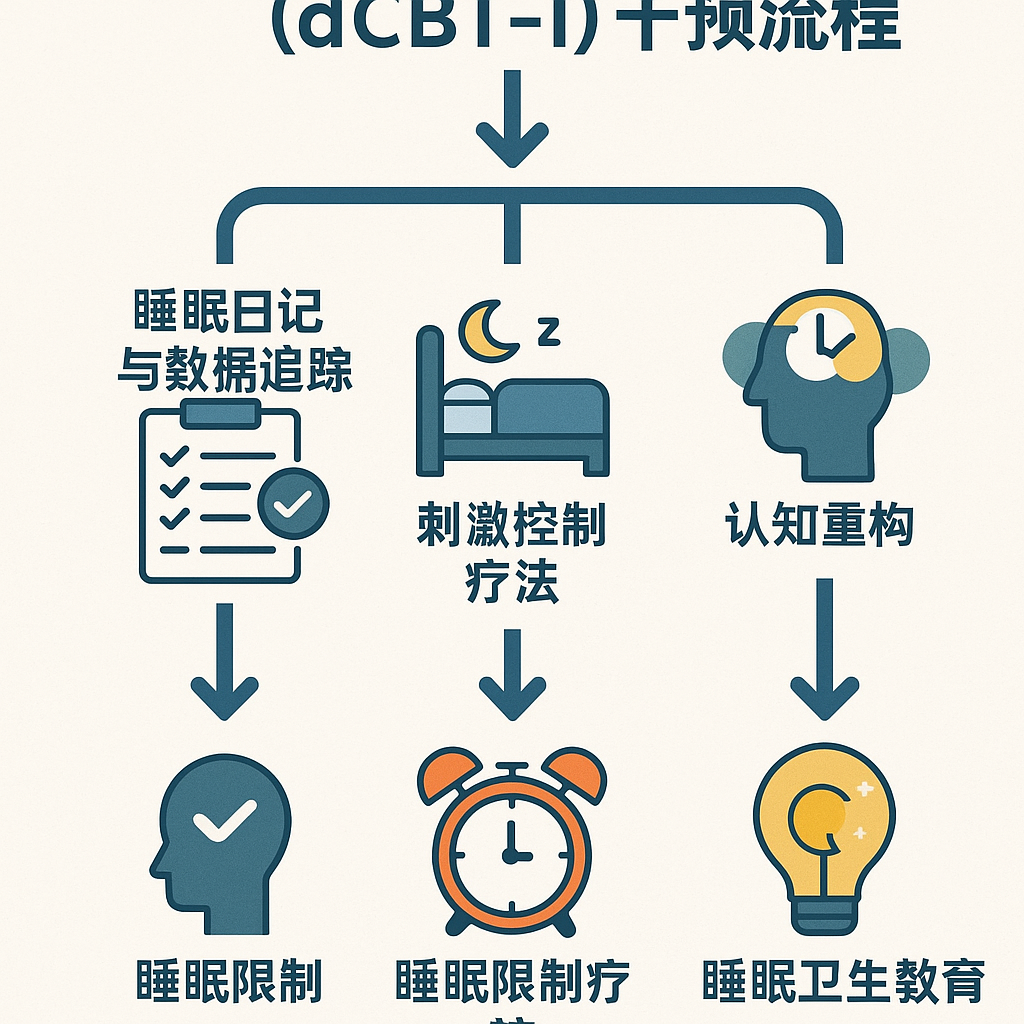 如图所示,dCBT-I 干预流程通常包括睡眠日记与数据追踪、刺激控制疗法、认知重建、睡眠限制和睡眠卫生教育等核心模块。尽管dCBT-I面临较高的用户流失率挑战(部分研究完成率仅约22%-28%)[3],但AI增强的dCBT-I通过整合机器学习、自然语言处理等技术,显著提升了用户体验和依从性 [3]。AI能够分析患者的睡眠日记和可穿戴设备数据,实现动态调整治疗计划和个性化内容推送,提升干预的针对性 [3]。研究显示,AI增强的dCBT-I用户参与率高达86%,依从率高达91% [3]。未来的策略建议融合人类辅导、引入激励机制、游戏化设计及文化适应性调整来进一步提升dCBT-I的依从性和完成率 [3]。
如图所示,dCBT-I 干预流程通常包括睡眠日记与数据追踪、刺激控制疗法、认知重建、睡眠限制和睡眠卫生教育等核心模块。尽管dCBT-I面临较高的用户流失率挑战(部分研究完成率仅约22%-28%)[3],但AI增强的dCBT-I通过整合机器学习、自然语言处理等技术,显著提升了用户体验和依从性 [3]。AI能够分析患者的睡眠日记和可穿戴设备数据,实现动态调整治疗计划和个性化内容推送,提升干预的针对性 [3]。研究显示,AI增强的dCBT-I用户参与率高达86%,依从率高达91% [3]。未来的策略建议融合人类辅导、引入激励机制、游戏化设计及文化适应性调整来进一步提升dCBT-I的依从性和完成率 [3]。新兴技术应用:人工智能赋能睡眠医学人工智能(AI)和机器学习已成为睡眠医学领域的强大工具,尤其在处理海量生理数据方面 [6]。 在睡眠数据分析方面,AI算法通过训练大规模多导睡眠图(PSG)数据集,实现了自动睡眠分期,准确性(Cohen’s κ 0.60-0.81)已能与人类专家媲美 [1, 6]。AI还能自动化检测呼吸事件、周期性肢体运动和皮层觉醒,并计算睡眠质量指标 [6]。 在疾病诊断和预测方面,AI有望实现更精准的筛查和分类。例如,AI模型可以基于 EKG 信号或简单的临床特征进行OSA的筛查和预测 [6]。AI也能根据 PSG 特征诊断和区分特定睡眠障碍(如发作性睡病 I 型) [6]。此外,AI 结合临床和 PSG 数据,被探索用于预测RBD患者发展为神经退行性疾病(如帕金森病)的风险 [6]。 在个性化治疗方面,AI具有优化治疗方案的潜力。通过整合来自PSG、CPAP设备、可穿戴设备和电子健康记录的实时数据,AI可以动态调整治疗参数(如 CPAP 压力),识别具有不同治疗反应机制的患者亚群,并预测治疗效果,从而支持睡眠医学的个性化 [6]。 然而,将AI广泛应用于临床仍面临挑战,包括算法的验证、透明度、数据标准化、隐私保护以及与现有系统的集成 [6]。专家普遍认为,AI应作为增强而非取代人类临床判断和护理交付的工具 [6]。
6. 生活方式调整与自我管理:触手可及的改变
良好的睡眠卫生和有效的自我管理是改善睡眠障碍的基础,也是所有治疗方案的重要组成部分。
- 睡眠卫生教育:建立规律的就寝和起床时间,即使在周末也尽量保持一致;将卧室打造为适合睡眠的环境——黑暗、安静、凉爽(18-22℃)。
- 饮食与饮水:睡前数小时(通常6小时内)避免摄入咖啡因和酒精;晚餐不宜过饱,睡前避免大量液体摄入。
- 规律运动:每日进行适度有氧运动(如快走30分钟),有助于改善睡眠,但应避免在睡前3小时内进行剧烈运动。
- 心理调适:学习和应用放松技巧(如深呼吸、渐进性肌肉放松、正念冥想)有助于降低睡前焦虑和生理唤醒;建立“担忧时间”,限制在睡前思考和解决问题。
- 警示信号:当出现严重日间嗜睡影响安全(如驾驶)、夜间伴发胸痛或呼吸困难、异态睡眠出现危及自身或他人安全行为时,应及时就医寻求专业评估。
7. 结论:迈向精准、整合、智能的睡眠健康管理
睡眠障碍是一个复杂且普遍的健康问题,其病因多元,影响深远。对其进行科学的诊断依赖于症状评估、标准化量表、睡眠日记以及多导睡眠图、便携式监测等多维度的探查。治疗需遵循个体化原则,整合应用心理行为疗法(尤其是核心的CBT-I及其数字化形式dCBT-I)、药物治疗(如新型的DORA类药物)以及物理治疗(如rTMS等神经调控技术)。近年来,以人工智能为代表的新兴技术在睡眠数据分析、疾病预测和个性化治疗方面展现出巨大潜力,正逐步推动睡眠医学迈向精准化、整合化和智能化的新时代。
展望未来,睡眠障碍的研究与临床实践将朝着以下方向发展:结合多组学数据和AI,实现更精准的诊断亚型和预测治疗反应的精准医疗;持续优化便携监测设备和AI算法的准确性、透明度和临床可解释性,提高技术的普及;加强多学科协作及人机结合的整合治疗模式研究;继续积累新型疗法在不同人群中的长期疗效与安全性数据;以及推动睡眠健康筛查和教育纳入公共健康策略,提升全社会对睡眠健康的认知和管理水平。
8. 参考文献
[1] Kwon S et al. Recent advances in wearable sensors and portable electronics for sleep monitoring. iScience. 2021 May 21;24(5):102461. PMCID: PMC8113882. DOI: 10.1016/j.isci.2021.102461. [2] Gkintoni E et al. The Latest Advances in Non-Invasive Neurostimulation for Insomnia. J Clin Med. 2023 Nov 24;12(23):7356. PMCID: PMC10690839. DOI: 10.3390/jcm12237356. (Note: Another reference on rTMS glymphatic link is mentioned in research, but full cite not provided. This ref [2] is a system review). [3] Gkintoni E et al. Digital and AI-Enhanced Cognitive Behavioral Therapy for Insomnia: Neurocognitive Mechanisms and Clinical Outcomes. J Clin Med. 2025 Apr 25;14(7):2265. DOI: 10.3390/jcm14072265. [4] Kunz D et al. Long-Term Safety and Tolerability of Daridorexant in Patients with Insomnia Disorder. CNS Drugs. 2022 Dec 9;37(1):93–106. PMCID: PMC9829592. DOI: 10.1007/s40263-022-00970-9. Rocha RB et al. Dual orexin receptor antagonists for the treatment of insomnia: systematic review and network meta-analysis. Arq Neuropsiquiatr. 2023 May 31;81(5):475–483. PMCID: PMC10232020. DOI: 10.1590/0004-282X-ANP-2023-0016. (Note: Yardley and Michelson refs for Lemborexant and Suvorexant long-term data were mentioned in research, but full cites were not provided in a standard format. The core DORA long-term safety/efficacy is well-covered by Kunz [4] and the Network Meta-analysis [4]). [5] Jahrami H. Editorial: Sleep problems: diagnosis, biomarkers, interventions, and treatments. Frontiers in Psychiatry. 2023 Sep 27;14:1291522. DOI: 10.3389/fpsyt.2023.1291522. Prather AA. Biomarkers of sleep and insomnia—challenges and opportunities. Sleep. 2022 Dec 8;45(12):zsac240. DOI: 10.1093/sleep/zsac240. [6] Malhotra A et al. Artificial Intelligence Models for the Automation of Standard Diagnostics in Sleep Medicine—A Systematic Review. J Clin Med. 2024 Feb 28;13(5):1322. PMCID: PMC10967859. DOI: 10.3390/jcm13051322. Bianchi MT et al. Artificial intelligence in sleep medicine: background and implications for the future. J Sleep Res. 2020 Jun;29(3):e13085. PMCID: PMC7161463. DOI: 10.1111/jsr.13085.