1. 引言
1.1 植物和草药在传统医学中的历史地位与经验价值
植物和草药在人类健康和疾病治疗中的应用历史悠久,是世界各地传统医学体系的重要组成部分 [1]。数千年来,中医药(Traditional Chinese Medicine, TCM)、印度阿育吠陀(Ayurveda)等古老的医学智慧都高度依赖药用植物作为主要的治疗手段 [1]。例如,印度的《查拉克本集》(Charak Samhita)和中国的《神农本草经》、《本草纲目》等经典古籍,系统地记载了大量药用植物的性味、功效、主治及配伍应用,这些知识体系是通过长期临床实践和经验积累形成的 [1]。非洲、南美洲等地区的传统医学同样广泛利用当地丰富的植物资源来应对各种疾病,特别是在现代医疗资源相对匮乏的地区,草药至今仍是初级卫生保健的重要支柱 [1]。
传统医学往往强调整体观念和辨证论治,在用药上常采用复方形式,利用多种植物成分之间的协同作用来达到治疗目的,而非仅仅依赖单一化学成分 [1]。这种基于经验的整体调节方法,旨在恢复机体的内在平衡,与现代医学针对特定靶点的治疗思路有所不同,但也为我们理解植物药复杂作用机制提供了独特的视角。
1.2 现代生化医学体系下的挑战与机遇
尽管植物与草药在传统医学中拥有丰富的经验价值,但在现代生化医学体系下,其推广和应用面临着诸多挑战。首先,植物和草药通常含有极其复杂的化学成分,这为有效成分的提取、分离、鉴定以及药理活性的精确验证带来了巨大困难。其次,传统草药的应用多依赖于经验传承,缺乏符合现代医学金标准的***大规模、随机、双盲、安慰剂对照的临床试验(RCTs)***来科学确证其疗效和安全性,这在一定程度上限制了其在主流医学中的接受度和应用范围 [2]。
然而,挑战与机遇并存。传统医学数千年的应用经验为现代药物的发现提供了宝贵的线索和丰富的天然化合物库。许多现代药物的发现都源于对传统药用植物的研究 [1]。据统计,全球约有25% 的现代处方药直接或间接来源于植物 [1]。这充分说明,植物和草药不仅是历史遗产,更是未来创新药物研发的战略资源。现代科学技术的发展,如先进的提取分离技术、高通量筛选技术、以及组学技术的应用,为系统揭示植物药的物质基础和作用机制提供了强有力的工具,有助于克服传统应用的局限性,推动植物药的现代化和国际化。
1.3 植物源药物的复兴与新药研发贡献
近年来,随着科学研究的不断深入,植物源药物的价值日益受到重视,并在新药研发领域取得了显著成就,迎来了复兴浪潮。其中,最广为人知的例子莫过于从传统中药青蒿中提取的青蒿素(Artemisinin)及其衍生物。青蒿素的发现不仅为全球疟疾治疗带来了革命性突破,挽救了数百万人的生命,也充分证明了从传统草药中发掘创新药物的巨大潜力,成为植物药现代化的里程碑事件 [1]。
事实上,植物源化合物对现代新药研发的贡献远不止于此。据用户查询中提及的数据,植物特性物质的提取用于疾病治疗的药物发展迅速,已达到新药数量的25%,这凸显了植物药在全球新药创制体系中的重要地位 [1]。近年来,各国药品监管机构也批准了若干源于植物或天然产物的新药。例如,美国食品药品监督管理局(FDA)在2023年批准了一种源自桦树皮的桦木三萜类化合物的复杂混合物(Birch triterpenes),其制剂名为Oleogel-S10 (Filsuvez®),用于治疗罕见遗传性皮肤病——大疱性表皮松解症(Epidermolysis Bullosa)的部分厚度伤口 [4]。这一批准被认为是植物提取物作为药物而非膳食补充剂获得FDA认可的一个罕见且重要的案例,尤其考虑到其治疗适应症的严重性 [4]。这些成功案例不仅直接丰富了临床治疗的选择,更重要的是,它们极大地激发了全球科研界对植物药研究的兴趣和投入,推动了相关提取、分析、药理评价和临床试验等技术平台的持续进步。
此外,中国的国家药品监督管理局(NMPA)近年来也批准了一系列重要的中药和植物药新药及适应症扩展申请,体现了政策对传统医药现代化的有力支持 [82]。例如:
- 参郁宁神片(Shenyu Ningshen Tablet): 作为中药复方,于2023年获得NMPA批准,用于治疗轻中度抑郁症(气阴两虚证)[82]。
- 小儿紫贝宣肺糖浆(Xiao'er Zibei Xuanfei Syrup): 中药复方,于2023年获得NMPA批准,用于治疗小儿急性气管-支气管炎(风热犯肺证)[82]。
- 通络明目胶囊(Tongluo Mingmu Capsule): 中药复方,于2023年获得NMPA批准,用于治疗中度非增殖性糖尿病视网膜病变(瘀血阻络、气阴两虚证)[82]。
- 枳实总黄酮片(Zhishi Total Flavonoids Tablet): 源自枳实(Citrus aurantium)的黄酮类成分,于2023年获得NMPA批准,用于治疗功能性消化不良 [82]。
- 香雷糖足膏(Xianglei Tangzu Gao): 中药复方,于2023年获得NMPA有条件批准,用于治疗1级糖尿病足溃疡 [82]。
这些批准案例反映了中国在推动中药和植物药现代化方面的具体进展,尤其是在复方制剂的临床价值验证和监管审批方面的努力。同时,一些中药复方也积极寻求国际认可,如丹参滴丸(Dantonic),已在美国完成了FDA三期临床试验(用于稳定性心绞痛),标志着中药国际化探索的深入 [83]。
传统经验与现代科学的融合是植物药发展的核心驱动力。传统医学体系积累了海量的药用植物应用数据和经验,为现代药物筛选提供了丰富的天然化合物库和潜在的药效线索。而现代科学,特别是生物化学、分子生物学、药理学以及临床医学的进步,为系统地验证这些传统应用的有效性、阐明其作用的物质基础和分子机制、并最终开发出安全有效的新型植物药提供了不可或缺的方法和标准。青蒿素的发现正是这一融合的典范。植物成分的内在复杂性,一方面给提取、分离和质量控制带来了挑战,要求发展更精细和标准化的技术手段;另一方面,这种复杂性也可能蕴含着独特的治疗优势,例如多种成分通过多靶点协同作用,可能比单一靶点药物在治疗复杂疾病时更具整体性和更低的副作用风险。每一个类似青蒿素的成功案例,都不仅仅是增加了一个新药,更重要的是它能显著提升科学界和社会对植物药价值的认可,从而吸引更多的科研资源投入到这一领域,形成正向的涟漪效应,推动整个植物药学科的理论创新和技术进步。
1.4 本文主旨、范围与结构
鉴于植物与草药在传统医学中的深厚底蕴及其在现代医药研发中的巨大潜力,本文旨在深度搜索与分析植物和草药领域研究的最新进展。重点将围绕植物医药成分的现代提取制备工艺、主要活性成分的科学确证、针对特定疾病的治疗应用与作用机制、临床试验的循证医学证据、质量控制与标准化策略、药用植物资源的可持续利用以及组学技术和人工智能等新兴技术在植物药研发中的应用等多个方面展开。通过对这些内容的系统梳理和深入探讨,力求验证和补充植物医药成分提取和治疗的实用价值,为相关领域的科研人员和从业者提供一篇内容翔实、论证充分、引用正确并附有参考文献支持的中文综述性文章。
本文的结构安排如下:首先概述植物药的历史与现状;其次,详细阐述药用植物主要活性成分的科学确证及其在多种疾病治疗中的应用和机制研究进展,并关注临床试验证据;再次,聚焦植物医药成分提取与制备工艺的最新技术;随后,讨论植物药的质量控制、标准化以及资源可持续发展面临的挑战与对策;接着,探讨组学技术和人工智能等新兴技术如何赋能植物药的研发;最后,对全文进行总结,并展望植物药在未来现代医疗体系中的发展前景。
2. 植物和草药的现代价值与挑战
药用植物的治疗作用根植于其所含有的多样化的化学成分。现代科学研究致力于分离、鉴定这些活性成分,阐明其化学结构、生物学功能以及在特定疾病治疗中的作用机制,从而为传统经验提供科学依据,并为新药开发奠定基础。
2.1 药用植物化学成分的多样性与复杂性
植物通过初级和次级代谢途径合成种类繁多的化合物。其中,次级代谢产物通常不直接参与植物的生长发育,但在植物与环境的相互作用中扮演重要角色,并且是药用植物发挥药理活性的主要物质基础 [1]。这些活性成分化学结构各异,主要可归为以下几大类:
- 生物碱类 (Alkaloids): 这是一类含氮的碱性有机化合物,通常具有显著的生理活性。许多著名的药物均属于生物碱,例如,来源于罂粟的吗啡具有强效镇痛作用;来源于金鸡纳树皮的奎宁是经典的抗疟药;来源于黄连、黄柏等植物的小檗碱(Berberine)具有广谱抗菌、抗炎、降血糖、抗肿瘤等多种药理活性 [1, 7, 8];来源于马达加斯加长春花的硫酸长春碱(Vinblastine)和硫酸长春新碱(Vincristine)是临床上广泛应用的抗癌药物 [1]。秋水仙中的秋水仙碱(Colchicine)则用于抗炎和治疗痛风 [1]。
- 黄酮类 (Flavonoids): 这是一大类广泛存在于植物中的多酚化合物,具有C6-C3-C6的基本碳骨架。黄酮类化合物以其强大的抗氧化能力而著称,能够清除自由基,保护细胞免受氧化损伤。此外,它们还表现出抗炎、抗病毒、抗肿瘤、保肝、改善心血管功能以及神经保护等多种生物学活性 [1]。常见的黄酮类化合物有槲皮素(Quercetin)、木犀草素(Luteolin)、山柰酚(Kaempferol)、儿茶素(Catechins)和大豆异黄酮(Soy Isoflavones)等。例如,银杏叶提取物中的黄酮类成分(如银杏内酯)具有抗氧化和神经保护作用 [1]。
- 萜类 (Terpenoids/Isoprenoids): 这是一类由异戊二烯单元构成的多样性化合物,是植物次级代谢产物中最大的一类。根据组成异戊二烯单元的数量,可分为单萜、倍半萜、二萜、三萜、四萜和多萜等。许多萜类化合物具有重要的药用价值。例如,来源于菊科植物青蒿的倍半萜内酯化合物青蒿素(Artemisinin)是高效的抗疟成分 [1];来源于红豆杉属植物的二萜类化合物紫杉醇(Paclitaxel)是广谱抗癌药物 [1, 13];人参中的主要活性成分人参皂苷(Ginsenosides)属于三萜皂苷类,具有免疫调节、抗疲劳、抗衰老、改善认知和神经保护等多种功效 [1, 18];此外,许多植物精油的主要成分也是单萜或倍半萜类化合物,如柠檬烯(Limonene)、芳樟醇(Linalool)、薄荷酮(Menthone)等,具有抗菌、抗炎、镇静、驱虫等作用 [1]。
- 酚类化合物 (Phenolic Compounds): 这是一类分子中含有酚羟基的化合物,除黄酮类外,还包括酚酸(Phenolic acids)、木脂素(Lignans)、芪类(Stilbenes)、香豆素(Coumarins)和鞣质(Tannins)等。它们同样具有广泛的生物活性,特别是抗氧化、抗炎、抗菌和抗肿瘤活性 [1]。例如,姜黄中的姜黄素(Curcumin)是一种强效的抗炎、抗氧化剂,并在抗肿瘤研究中显示出巨大潜力 [1, 20, 21];葡萄、虎杖等植物中的白藜芦醇(Resveratrol)以其抗氧化、抗衰老和心血管保护作用而闻名 [1, 24, 25];肉桂中的肉桂醛(Cinnamaldehyde)和丁香中的丁香酚(Eugenol)兼具抗菌和抗氧化活性,并有调节血糖等作用 [1]。
- 皂苷 (Saponins): 这是一类结构复杂、通常具有表面活性的糖苷类化合物,其苷元为三萜或甾体。除人参皂苷外,甘草中的甘草皂苷具有抗炎、抗病毒、保肝等作用;柴胡中的柴胡皂苷具有抗炎、解热、镇静等作用 [1]。
- 多糖 (Polysaccharides): 这是一类由多个单糖分子通过糖苷键连接而成的高分子碳水化合物。许多药用植物多糖具有免疫调节、抗肿瘤、抗病毒、降血糖、抗氧化等活性 [1, 27]。例如,枸杞多糖、黄芪多糖、香菇多糖等均是研究较多的具有生物活性的植物多糖。
为了更清晰地展示这些主要活性成分及其功能,下表进行了总结:
表格 1: 主要药用植物活性成分类别、代表性化合物及主要生物活性
| 活性成分类别 | 代表性化合物举例 | 主要生物活性 | 参考文献举例 |
|---|---|---|---|
| 生物碱类 (Alkaloids) | 小檗碱 (Berberine) | 降血糖、抗炎、抗菌、抗肿瘤 | [1, 7] |
| 长春碱 (Vinblastine) | 抗肿瘤 | [1] | |
| 吗啡 (Morphine) | 镇痛 | [1] | |
| 黄酮类 (Flavonoids) | 槲皮素 (Quercetin) | 抗氧化、抗炎、抗肿瘤、神经保护 | [1] |
| 木犀草素 (Luteolin) | 抗氧化、抗炎、神经保护 | [10] | |
| 儿茶素 (Catechins) (如EGCG) | 抗氧化、抗肿瘤、神经保护 | [5, 28] | |
| 萜类 (Terpenoids) | 青蒿素 (Artemisinin) | 抗疟疾 | [1, 11] |
| 紫杉醇 (Paclitaxel) | 抗肿瘤 | [1, 13] | |
| 人参皂苷 (Ginsenosides) | 免疫调节、神经保护、抗疲劳 | [1, 18] | |
| 酚类化合物 (Phenolics) | 姜黄素 (Curcumin) | 抗炎、抗氧化、抗肿瘤 | [1, 20] |
| 白藜芦醇 (Resveratrol) | 抗氧化、神经保护、心血管保护 | [1, 24] | |
| 肉桂醛 (Cinnamaldehyde) | 抗菌、抗氧化、调节血糖 | [1] | |
| 皂苷 (Saponins) | 甘草皂苷 | 抗炎、抗病毒、保肝 | [1] |
| 柴胡皂苷 | 抗炎、解热 | [1] | |
| 多糖 (Polysaccharides) | 黄芪多糖 | 免疫调节、抗肿瘤、降血糖 | [1, 27] |
| 枸杞多糖 | 免疫调节、抗氧化 | [9] |
这些活性成分的多样性及其广泛的生物学功能,构成了植物药治疗价值的物质基础,并为现代药物的发现和开发提供了源源不断的灵感和资源。
2.2 传统经验应用价值的科学审视
基于上述活性成分的药理作用,药用植物及其提取物在多种急慢性疾病的预防和治疗中显示出应用潜力。传统医学积累了数千年的应用经验,在许多疾病的长期管理和改善症状方面展现出其独特性。例如,中医药在治疗慢性病、亚健康状态以及某些疑难杂症方面,常能发挥独特的优势,许多疾病的传统治疗方案已在临床实践中反复验证。
然而,这种基于经验的应用模式在现代科学体系下也面临挑战。主要的局限性在于:
- 缺乏大样本、高质量的临床证据: 许多传统应用仅基于小规模的临床观察或个案经验,缺乏符合现代循证医学要求的大规模、随机、双盲、安慰剂对照试验 [2]。这使得其疗效和安全性的科学确证受限,难以获得主流医学界的广泛认可。
- 传统毒性认识与现代安全评估的差异: 传统医学对药物毒性的认识主要基于长期经验观察到的临床不良反应,缺乏现代药理毒理学所需的分子、细胞和整体水平的系统性评估。一些植物药中可能含有潜在的肝肾毒性、遗传毒性、生殖毒性等风险成分,需要通过现代毒性评估方法进行深入研究 [1]。
- 物质基础和作用机制不明确: 传统医学通常对植物药的物质基础和作用机制只有模糊的认识(如性味归经),缺乏现代分子生物学和药理学层面的精细阐释。这限制了对其临床应用的精准指导和创新药物的开发。
2.3 面临的现代科学挑战
将传统经验丰富的植物药转化为现代安全有效的药物,需要克服一系列现代科学挑战:
- 活性成分的确定与复杂成分间的相互作用: 植物药通常含有复杂的化学混合物,确定哪一个或哪一组成分是其发挥药效的物质基础是核心难题。同时,这些复杂成分之间可能存在协同、拮抗或增毒等相互作用,进一步增加了研究的复杂性 [1]。
- 作用机制的复杂性: 与许多现代化学药物的单靶点作用不同,植物药常通过多成分、多靶点、多通路协同作用发挥疗效 [5]。这使得阐明其完整的分子机制非常困难,需要整合多种现代技术。
- 药代动力学(ADME)特性研究困难: 植物药中的活性成分种类繁多,其在体内的吸收、分布、代谢、排泄和毒性(ADMET)特性差异很大。尤其是复杂混合物,研究其整体的药代动力学行为极具挑战 [2]。许多具有良好体外活性的植物成分在体内可能生物利用度极低或代谢迅速,难以达到有效血药浓度 [2]。
- 质量控制和标准化的瓶颈: 由于药用植物的天然变异性、种植环境、采收时间、加工炮制等因素的影响,不同批次、不同产地的药材质量差异显著 [1]。建立一套科学、可重复、国际公认的质量控制标准是植物药国际化面临的关键瓶颈 [70]。
- 资源的可持续性和环境影响: 市场需求的增加导致部分野生药用植物资源过度采挖甚至濒危 [72]。同时,传统的农业种植方式可能存在农药、化肥残留等问题,影响药材质量并对环境造成影响 [1]。
- 潜在的毒性与药物相互作用风险: 即使是传统经验中认为是安全的草药,在现代医学背景下仍需进行系统的毒性评估,特别是在长期使用或与其他药物联合使用的情况下。某些植物成分可能存在肝肾毒性、药物相互作用(DDI)等风险,需要深入研究和预警 [1, 3]。
克服这些挑战,需要整合化学、生物学、药理学、临床医学、生物信息学以及现代工程技术等多学科的知识和方法,推动植物药研究向更科学、更规范、更精准的方向发展。
3. 植物医药成分提取、分离与分析的最新进展
从药用植物中高效、经济、环保地提取和制备活性成分,是植物药现代化和产业化的关键环节。提取工艺的优劣直接影响活性成分的得率、纯度、稳定性以及最终产品的质量和成本。近年来,随着科学技术的发展,植物提取技术不断创新,从传统的经典方法向绿色、高效、智能化的方向发展。
3.1 传统提取方法回顾与局限性
传统的植物活性成分提取方法主要依赖于溶剂萃取原理,利用不同溶剂对植物中各类成分溶解度的差异进行分离。常见的传统提取方法包括:
- 浸渍法 (Maceration): 将植物药材粉碎后,用适宜的溶剂(如水、乙醇等)在室温或温和加热条件下浸泡一定时间,使有效成分溶解出来 [49]。此法操作简便,但提取时间较长,效率相对较低。
- 渗漉法 (Percolation): 使溶剂自上而下匀速流过粗粉状的植物药材层,不断溶解出有效成分 [49]。此法较浸渍法效率略高,但仍需较长时间和较多溶剂。
- 煎煮法 (Decoction): 是中药汤剂最常用的制备方法,将药材加水共煮,利用高温使水溶性成分溶出 [1]。适用于水溶性、性质稳定的成分,但对热敏性成分可能造成破坏。
- 回流提取 (Reflux extraction): 将药材与溶剂混合加热至沸腾,产生的蒸汽经冷凝后回流入提取器,实现连续提取 [49]。此法溶剂利用率较高,提取较完全,但长时间加热可能影响热敏性成分。
- 索氏提取 (Soxhlet extraction): 利用溶剂回流和虹吸原理,对固体物料进行连续提取 [12]。此法提取效率较高,但同样存在耗时长、高温可能破坏活性成分等问题,且溶剂消耗量较大 [50]。
这些传统提取方法虽然在历史上发挥了重要作用,并仍在某些场合应用,但普遍存在一些局限性,例如:提取时间长、溶剂消耗量大(通常是有机溶剂,可能存在毒性和环境污染问题)、提取效率不高、选择性较差、能耗高、以及热敏性活性成分容易在长时间加热过程中降解或失活等 [7]。这些不足限制了它们在现代植物药大规模、高质量、可持续生产中的应用。
3.2 绿色与可持续提取技术的革新
为了克服传统提取方法的局限性,满足现代制药对高效、节能、环保和产品高质量的要求,“绿色化学”和“可持续发展”的理念被引入植物提取领域,催生了一系列新型绿色提取技术。这些技术旨在减少或避免使用有毒有害溶剂,降低能源消耗,缩短提取时间,提高提取效率和产品纯度。
- 超临界流体提取 (Supercritical Fluid Extraction, SFE):
- 原理:利用物质在超临界状态(温度和压力均高于其临界点)下兼具气体和液体的特性(如高密度、低粘度、高扩散系数、良好的溶解能力)进行提取。二氧化碳(CO2)是最常用的超临界流体,因其临界条件温和 (Tc = 31.1 ∘C, Pc = 7.38 MPa)、无毒、不燃、价廉、易得,且提取后通过降压或升温即可与产物分离,无溶剂残留 [1]。
- 优势:特别适用于提取非极性或弱极性、热敏性、易氧化成分,如精油、脂溶性维生素、天然色素、生物碱(如小檗碱 [7])、萜类(如青蒿素 [12]、紫杉醇 [13])、酚类(如姜黄素 [1])等。提取效率高,选择性好,产品纯度高,环境友好。
- 局限性:设备投资较高,操作压力高,对强极性化合物的提取效率较低,除非添加极性改性剂(如乙醇、甲醇)[12]。
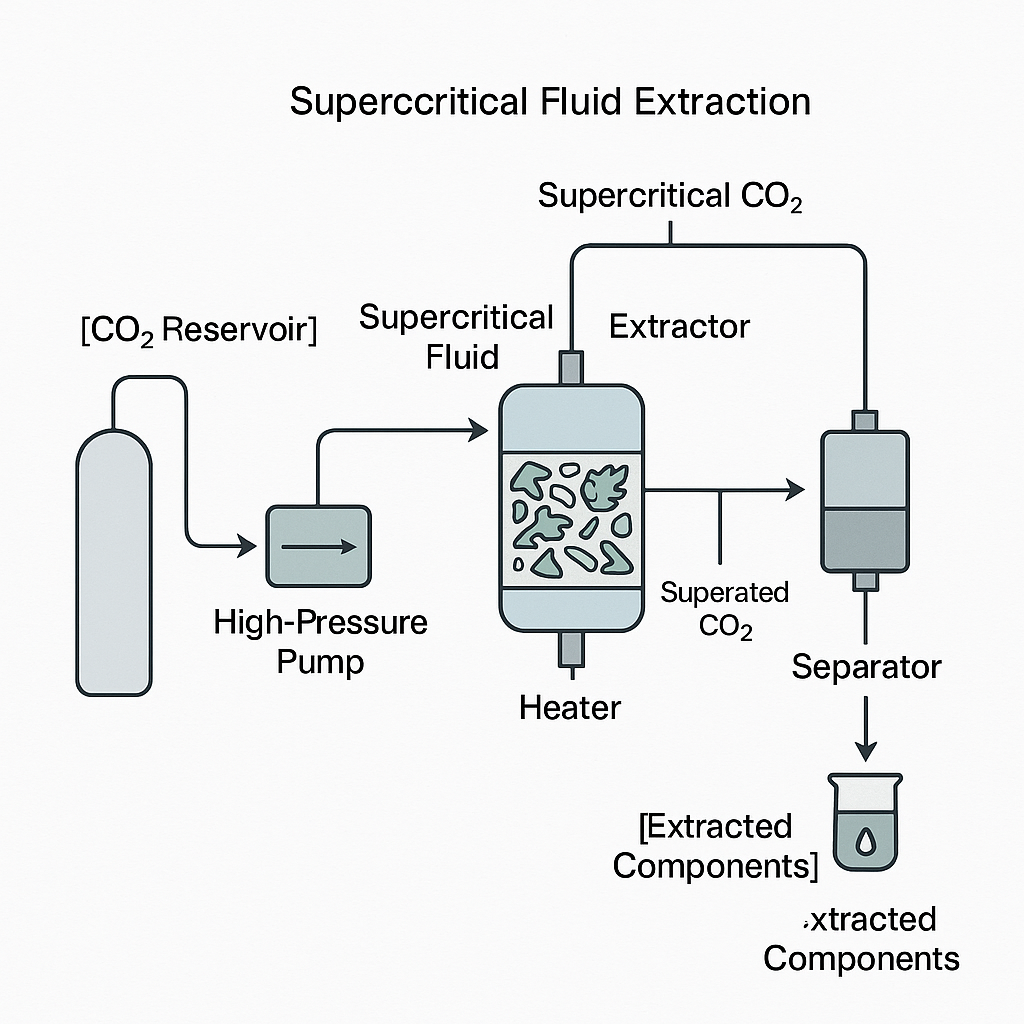 **图1:超临界流体提取(SFE)技术原理示意图。**该图描绘了使用超临界二氧化碳从植物材料中提取活性化合物的关键组件和过程流程。
**图1:超临界流体提取(SFE)技术原理示意图。**该图描绘了使用超临界二氧化碳从植物材料中提取活性化合物的关键组件和过程流程。
- 微波辅助提取 (Microwave-Assisted Extraction, MAE):
- 原理:利用微波(频率通常为2.45 GHz)与极性溶剂分子和植物样品中的水分相互作用,产生偶极旋转和离子传导,使样品内外同时、快速、均匀加热。细胞内水分受热膨胀产生压力,导致细胞壁破裂,加速目标成分溶出和传质 [7]。
- 优势:提取速度快(通常几分钟到几十分钟),效率高,溶剂用量少,能耗低,自动化程度高。适用于多种极性溶剂。
- 局限性:微波的穿透深度有限,对大体积样品处理可能不均匀;局部过热可能导致某些热敏性成分降解;对非极性溶剂或干样品的加热效果差;提取液中可能含有较多杂质,需进一步纯化 [55]。
- 超声辅助提取 (UAE):
- 原理:利用高频声波(通常 >20 kHz)在液体介质中产生的空化效应。空化泡的形成、生长和爆裂产生强烈的机械剪切力、微射流、冲击波和局部高温高压,能有效破坏植物细胞壁和细胞膜,增大溶剂的渗透性,加速细胞内成分的释放和扩散,强化传质过程 [7]。
- 优势:操作简便,提取时间短,通常在较低温度下进行,有利于保护热敏性成分,溶剂消耗少,提取效率较高。
- 局限性:高强度超声可能产生自由基,导致某些活性成分氧化或降解;空化效应受溶剂性质(粘度、表面张力等)影响;工业化放大生产仍面临一些技术挑战,如能量传递均匀性和设备成本 [55]。
- 酶辅助提取 (Enzyme-Assisted Extraction, EAE):
- 原理:利用具有特异性的酶(如纤维素酶、半纤维素酶、果胶酶、蛋白酶等)在温和条件下水解植物细胞壁的主要成分(纤维素、半纤维素、果胶、蛋白质等),破坏细胞壁结构,从而促进细胞内目标活性成分的释放和溶出 [49]。
- 优势:提取条件温和(较低温度、中性pH),能有效保护活性成分的生物活性;选择性高,可以针对性地降解细胞壁组分;溶剂用量少,环境友好,产物纯度较高。
- 局限性:酶的成本相对较高;酶的活性易受温度、pH、底物浓度等因素影响,反应条件需要精确控制;提取时间可能相对较长;酶的失活和去除可能增加后续纯化步骤 [57]。
- 加压液体提取 (Pressurized Liquid Extraction, PLE) / 加速溶剂提取 (Accelerated Solvent Extraction, ASE) / 亚临界水提取 (Subcritical Water Extraction, SWE):
- 原理:在较高的压力下(通常5-20 MPa),将溶剂(水或有机溶剂)加热到其常压沸点以上但低于其临界点的温度,使其保持液态。高温高压显著降低了溶剂的粘度和表面张力,增加了其扩散系数和对目标化合物的溶解能力,从而大大提高了提取速率和效率 [7]。当使用水作为溶剂时,即为亚临界水提取(SWE),此时水的极性会随着温度升高而降低,使其能够有效提取中等极性甚至弱极性的化合物。
- 优势:提取速度快,效率高,溶剂用量显著减少,自动化程度高。SWE使用水作为溶剂,成本极低,无毒环保,被认为是一种极具潜力的绿色提取技术。
- 局限性:设备需要在高压下运行,对设备要求较高,初始投资较大;高温条件仍可能对某些高度不稳定的热敏性化合物造成一定程度的降解 [57]。
- 天然低共熔溶剂提取 (Natural Deep Eutectic Solvents, NADES):
- 原理:NADES是由两种或多种天然来源的固体化合物(如胆碱、氨基酸、糖类、有机酸等)按一定摩尔比混合形成的低共熔混合物,其熔点远低于各组分的熔点,在室温或温和加热下呈液态。NADES通过氢键等分子间作用力与目标化合物相互作用,实现高效溶解和提取 [12]。
- 优势:成分天然、生物相容性好、可生物降解、毒性低或无毒、制备简单、成本较低、对多种极性和非极性化合物均有较好的溶解能力,被认为是极具前景的绿色溶剂。
- 局限性:粘度通常较高,可能影响传质效率;提取后溶剂的回收和目标产物的分离可能较为复杂;其长期稳定性和对特定化合物提取的普适性仍需进一步研究。
- 脉冲电场提取 (Pulsed Electric Field Extraction, PEFE):
- 原理:将植物材料置于两个电极之间,施加短暂的高压电脉冲(数千伏/厘米,微秒或毫秒级)。强电场作用下,细胞膜发生电穿孔现象,形成暂时性或永久性的微孔,从而显著提高细胞膜的通透性,促进细胞内含物的释放 [7]。
- 优势:非热效应提取,能有效保护热敏性成分;处理时间极短,能耗低;可提高提取率和缩短提取时间,尤其适用于细胞内目标产物的提取。
- 局限性:设备成本较高;处理效果受电场强度、脉冲宽度、脉冲次数、样品电导率和质地等多种因素影响;对大块或不规则样品的处理均匀性可能存在问题;高压操作需注意安全 [57]。
这些新型绿色提取技术各有特点,在实际应用中常需要根据目标化合物的性质、植物基质的特点、生产规模以及经济成本等因素综合考虑,选择最适宜的技术或多种技术的组合。
表格 2: 新型绿色提取技术对比
| 技术名称 (英文缩写) | 主要原理 | 主要优势 | 主要局限性 | 典型应用举例 (活性成分) | 参考文献举例 |
|---|---|---|---|---|---|
| 超临界流体提取 (SFE) | 利用超临界流体的特殊溶剂性质 | 无毒、无残留、选择性好、低温操作 | 设备贵、对极性物提取需改性剂 | 精油、脂类、青蒿素、紫杉醇、姜黄素、小檗碱 | [1, 12] |
| 微波辅助提取 (MAE) | 微波选择性快速加热 | 快速、高效、溶剂少 | 可能热降解、对非极性溶剂效果差 | 多酚、黄酮、生物碱、姜黄素 | [50] |
| 超声辅助提取 (UAE) | 声空化效应强化传质 | 快速、低温、溶剂少、操作简便 | 可能氧化降解、放大困难 | 多酚、皂苷、青蒿素、姜黄素 | [12] |
| 酶辅助提取 (EAE) | 酶解细胞壁促进释放 | 条件温和、选择性高、环保 | 酶成本高、时间可能较长、条件敏感 | 多糖、酚类、姜黄素 | [50] |
| 加压液体提取 (PLE/ASE) / 亚临界水提取 (SWE) | 高温高压下溶剂液态提取 / 水作溶剂 | 快速、高效、溶剂少 (SWE 用水) | 设备要求高、高温可能降解 | 多酚、生物碱、皂苷、姜黄素 | [50] |
| 天然低共熔溶剂提取 (NADES) | 利用低共熔混合物溶解 | 绿色、生物相容性好、设计性强 | 粘度高、产物分离可能复杂 | 黄酮、酚酸、生物碱 | [49] |
| 脉冲电场提取 (PEFE) | 高压脉冲电穿孔细胞膜 | 非热、快速、节能 | 设备贵、受样品特性影响大 | 细胞内色素、糖类、多酚 | [57] |
3.3 活性成分分离纯化与结构确证技术的进步
从复杂的植物提取物中获得高纯度的单一活性成分或特定组分,需要经过一系列高效的分离纯化步骤。随后,对这些纯化产物的化学结构进行精确确证,是理解其构效关系和进行药物开发的基础。
常用的分离纯化技术包括各种色谱技术,如硅胶柱色谱、凝胶柱色谱、离子交换色谱、大孔吸附树脂色谱等传统柱色谱法,以及更高效的高效液相色谱法(High-Performance Liquid Chromatography, HPLC),特别是制备型HPLC(Preparative HPLC),用于高纯度化合物的制备 [1]。气相色谱法(Gas Chromatography, GC)主要用于挥发性或可衍生化为挥发性化合物的分离。随着技术发展,超高效液相色谱(UPLC)的出现显著缩短了分析时间并提高了分辨率 [64]。
活性成分的结构确证则依赖于多种波谱学和质谱学技术。质谱法(Mass Spectrometry, MS),特别是与色谱联用时(如LC-MS, GC-MS),能够提供化合物的精确分子量和碎片离子信息,是鉴定已知化合物和推断未知化合物结构的重要工具 [1]。核磁共振波谱法(Nuclear Magnetic Resonance, NMR),包括一维(1H NMR, 13C NMR)和二维NMR(如COSY, HSQC, HMBC),是阐明有机化合物(特别是新化合物)完整化学结构的最强大和最明确的手段 [1]。红外光谱法(Infrared Spectroscopy, IR)和紫外可见光谱法(UV-Visible Spectroscopy, UV-Vis)则可以提供化合物中官能团和共轭体系的信息,辅助结构鉴定 [1]。
LC-NMR 等联用技术的出现,进一步增强了对复杂混合物中微量成分在线结构解析的能力 [1]。高分辨率质谱(HRMS)和串联质谱(MS/MS)技术的发展,使得对复杂天然产物混合物的快速鉴定和结构推断成为可能。通过结合分子网络(Molecular Networking)等生物信息学工具,可以更高效地发现新的活性成分和了解已知成分的结构多样性。
3.4 生物技术在药用植物活性成分生产中的应用
传统上依赖野生采挖或农田种植获取药用植物原料的方式,面临着资源枯竭、质量参差不齐、生长周期长等问题。生物技术的发展为药用植物活性成分的可持续、规模化、高质量生产提供了新的途径 [68]。
- 植物细胞、组织和器官培养: 通过在无菌条件下培养植物的细胞、组织(如愈伤组织)或器官(如毛状根),可以在可控的环境中诱导其次级代谢产物的生物合成 [1]。例如,紫杉醇最初是从红豆杉树皮中提取,但资源稀缺,后来通过红豆杉细胞培养技术实现了工业化生产 [1]。毛状根培养系统因其生长快速、遗传稳定、次级代谢产物合成能力强等优点,在生产多种生物碱、萜类等活性成分方面显示出巨大潜力 [68]。
- 代谢工程与合成生物学: 运用基因工程手段,对药用植物或其培养细胞中活性成分的生物合成途径进行定向改造,以提高目标产物的产量或积累特定的有价值成分 [63]。这包括过表达途径中的关键酶基因、限速酶基因,抑制或敲除竞争性代谢途径的基因,引入新的基因构建新的合成途径等。合成生物学则进一步整合工程学理念,从头设计或改造生物系统,实现复杂天然产物的异源高效合成。例如,利用酵母等微生物底盘细胞合成源自中国传统药用植物的萜类化合物,为活性成分的大规模获取提供了新的途径 [来源于参考文献中提到的相关主题,具体未直接引用自编号文献]。
- 基因编辑技术: 以CRISPR-Cas9为代表的基因编辑技术,因其高效、精准、便捷的特点,正被越来越多地应用于药用植物的遗传改良和次级代谢调控研究中,为定向提升活性成分含量或改变成分谱提供了强大工具 [68]。例如,编辑调控次级代谢通路的转录因子基因,以提高目标产物的积累量。
- 植物内生菌利用: 许多药用植物体内共生着内生真菌或细菌,其中一些内生菌能够合成与宿主植物相同或相似的活性成分,或者能够产生促进宿主植物合成活性成分的物质。通过分离、筛选和发酵培养这些有益内生菌,有望开辟一条获取药用活性成分的新途径,例如利用内生真菌发酵生产紫杉醇 [14]。
提取技术的革新,特别是绿色高效技术的涌现,是植物药实现现代化的核心驱动力。这些技术不仅提高了活性成分的提取效率和产品质量,还显著降低了生产成本和环境影响,为植物药的深入研究和广泛应用奠定了物质基础。“绿色化学”和“可持续发展”的理念已成为该领域技术研发的主导方向,推动着行业向更环保、更经济、更安全的目标迈进。然而,没有任何一种提取技术是万能的,针对不同植物材料和目标成分的特性,进行参数优化和多种技术的协同组合,是实现最佳提取效果的关键策略。与此同时,生物技术,如植物细胞培养和代谢工程,为那些来源稀缺或难以人工栽培的药用植物活性成分的生产提供了重要的替代方案,尽管其规模化生产的成本控制和技术稳定性仍是需要持续攻克的难题。
4. 植物医药在疾病治疗中的应用与验证
4.1 针对特定疾病的治疗应用与作用机制新发现
基于上述活性成分的药理作用,药用植物及其提取物在多种急慢性疾病的预防和治疗中显示出应用潜力。近年来,针对特定疾病的治疗应用及其作用机制的研究取得了显著进展。
4.1.1 抗肿瘤
肿瘤是全球范围内严重威胁人类健康的重大疾病之一。植物源化合物因其独特的化学结构和多样的作用机制,在抗肿瘤药物研发中占据重要地位。许多临床一线抗癌药物,如紫杉醇(Paclitaxel)、长春碱(Vinblastine/Vincristine)、喜树碱(Camptothecin)及其衍生物,均直接来源于植物 [1, 5]。此外,大量研究表明,姜黄素(Curcumin)、小檗碱(Berberine)、表没食子儿茶素没食子酸酯(EGCG)、白藜芦醇(Resveratrol)等植物多酚和生物碱也具有显著的抗肿瘤活性 [1, 5]。
植物源抗肿瘤化合物的作用机制复杂多样,往往涉及多个信号通路和细胞过程 [5]。主要机制包括:
- 调控关键信号通路: 许多植物成分能够选择性地作用于肿瘤细胞中异常活化的信号通路,从而抑制肿瘤细胞的增殖和存活。例如,PI3K/Akt/mTOR通路在多种肿瘤中过度活化,姜黄素、萝芙木素和胡椒碱等均被报道能下调此通路 [5]。JAK/STAT通路与细胞增殖和凋亡密切相关,飞燕草素(Delphinidin)可通过调节JAK/STAT3信号诱导结肠癌细胞凋亡 [5]。NF-κB通路在肿瘤炎症和免疫逃逸中起关键作用,小檗碱、硫代葡萄糖苷和人参皂苷等能通过抑制NF-κB活性发挥抗肿瘤效应 [5]。MAPK通路参与调控细胞生长、分化和凋亡,小檗碱、厚朴酚和姜黄素等均能影响MAPK通路活性 [5]。Wnt/β-catenin通路与肿瘤干细胞的自我更新和耐药性相关,白藜芦醇和硫代葡萄糖苷等可抑制该通路 [5]。
- 诱导细胞凋亡(Apoptosis): 细胞凋亡是程序性细胞死亡,是机体清除异常细胞的重要机制。许多植物活性成分能够通过内源性(线粒体)或外源性(死亡受体)途径诱导肿瘤细胞凋亡。例如,姜黄素可通过线粒体功能障碍和内质网应激诱导白血病细胞凋亡 [5];鱼藤酮(Deguelin)可促进细胞色素C释放,诱导凋亡 [5];长春花碱通过干扰微管聚合,进而激活凋亡程序 [5]。
- 抑制血管生成(Angiogenesis): 肿瘤的生长和转移依赖于新生血管的形成。一些植物成分能够抑制肿瘤血管生成,从而“饿死”肿瘤。例如,小檗碱可通过下调缺氧诱导因子-1(HIF-1)和血管内皮生长因子(VEGF)的表达来抑制血管生成 [5];EGCG则通过抑制HIF-1α和NF-κB的活化以及VEGF的表达来抑制乳腺癌的血管生成 [5]。
- 抑制肿瘤转移(Metastasis): 肿瘤转移是导致癌症患者死亡的主要原因。部分植物成分能够通过抑制肿瘤细胞的侵袭、迁移以及上皮间质转化(EMT)等过程来抑制肿瘤转移。例如,印度人参(Withania somnifera)根提取物能抑制乳腺癌的转移和EMT过程 [5];胡椒碱能抑制乳腺癌细胞的增殖和转移 [5]。
这些研究不仅揭示了植物药抗肿瘤的科学内涵,也为开发新型、高效、低毒的抗肿瘤药物提供了重要的先导化合物和作用靶点。
4.1.2 抗糖尿病
糖尿病是一种以持续性高血糖为特征的代谢性疾病,其发病率在全球范围内持续上升。传统医学中早已记载多种植物用于治疗“消渴症”(类似于糖尿病)。现代研究证实,许多植物及其活性成分在糖尿病及其并发症的防治中具有积极作用 [1, 9]。例如,小檗碱、苦瓜中的多肽类物质(如苦瓜素)、肉桂中的肉桂醛、人参中的人参皂苷、以及多种黄酮类化合物(如槲皮素、山柰酚)等均显示出良好的降血糖和改善代谢紊乱的潜力 [1, 9, 32]。
植物源抗糖尿病成分的作用机制主要包括 [1, 9, 10]:
- 抑制碳水化合物消化酶: 通过抑制小肠黏膜刷状缘的α-葡萄糖苷酶和/或胰腺α-淀粉酶的活性,延缓碳水化合物的消化吸收,从而降低餐后血糖。许多生物碱、黄酮类和多酚类化合物具有此作用 [9]。
- 促进胰岛素分泌和保护胰岛β细胞: 一些植物成分能够刺激胰岛β细胞分泌胰岛素,或通过抗氧化、抗炎、抗凋亡等机制保护胰岛β细胞功能,延缓其衰竭。例如,黄酮类化合物可通过调节GLP-1和PKA通路增强胰岛素分泌,并通过抗氧化和激活Nrf2通路促进胰岛β细胞再生 [9]。人参皂苷、薯蓣皂苷等也能促进胰岛素分泌 [33]。
- 改善胰岛素敏感性: 胰岛素抵抗是2型糖尿病的主要病理生理特征。部分植物成分能够增强外周组织(如肌肉、脂肪、肝脏)对胰岛素的敏感性,促进葡萄糖的摄取和利用。这可能通过调控胰岛素信号通路中的关键分子,如激活AMP依赖的蛋白激酶(AMPK)、过氧化物酶体增殖物激活受体γ(PPARγ)等实现 [10, 38]。小檗碱是激活AMPK的典型代表 [38]。
- 调节葡萄糖转运和肝脏糖代谢: 影响葡萄糖转运体(如GLUT4)的表达和易位,促进葡萄糖进入细胞内。同时,抑制肝脏糖异生,促进肝糖原合成,从而降低空腹血糖 [10]。
- 抗氧化和抗炎作用: 氧化应激和慢性炎症在糖尿病及其并发症的发生发展中起重要作用。许多具有抗氧化和抗炎活性的植物成分,如多酚、黄酮类,能够减轻这些病理损伤,从而间接改善血糖控制和预防并发症 [1]。
植物药因其多靶点、多途径的调节作用,在糖尿病的综合管理中显示出独特优势,可作为现有治疗方案的有益补充。
4.1.3 神经退行性疾病(AD, PD等)
神经退行性疾病,如阿尔茨海默病(Alzheimer's Disease, AD)和帕金森病(Parkinson's Disease, PD),是老年人群中常见的致残和致死性疾病,目前仍缺乏根治性治疗方法。越来越多的研究表明,植物源天然产物在神经保护和延缓这些疾病进展方面具有巨大潜力 [1, 15]。代表性的植物活性成分包括姜黄素、白藜芦醇、银杏叶提取物中的黄酮和萜内酯、人参皂苷、绿茶中的EGCG等 [1, 15, 28]。
这些植物成分的神经保护机制主要体现在以下几个方面 [15, 22, 23]:
- 抗氧化应激: 氧化应激是神经退行性疾病发生发展的重要因素。许多植物多酚和黄酮类化合物具有强大的自由基清除能力,能够激活细胞内源性抗氧化通路(如Nrf2/ARE通路),从而减轻氧化损伤,保护神经元 [15]。
- 抗神经炎症: 慢性神经炎症在神经退行性变过程中扮演关键角色。植物成分如姜黄素、白藜芦醇、EGCG等可以通过抑制NF-κB等炎症信号通路的活化,减少促炎细胞因子(如TNF-α, IL-1β, IL-6)的产生,调节小胶质细胞和星形胶质细胞的活化状态,从而发挥抗炎作用,保护神经元免受炎症损伤 [15]。
- 抑制异常蛋白聚集: AD的病理特征是β-淀粉样蛋白(Aβ)斑块和Tau蛋白神经纤维缠结的形成;PD的特征是α-突触核蛋白(α-synuclein)路易小体的形成。一些植物成分,如EGCG和姜黄素,被发现可以直接干扰这些蛋白的错误折叠和聚集过程,促进其降解,或调节相关酶(如β-分泌酶、γ-分泌酶)的活性,从而减少毒性蛋白聚集体的形成 [20]。
- 调节神经递质系统: 部分植物成分可以影响神经递质的合成、释放、代谢和受体功能,从而改善认知和运动功能。例如,石杉碱A(Huperzine A)是一种乙酰胆碱酯酶抑制剂,用于改善AD患者的认知功能 [1]。
- 保护线粒体功能: 线粒体功能障碍是神经退行性疾病的共同特征。白藜芦醇等成分可以通过激活SIRT1-AMPK-PGC-1α通路,促进线粒体生物合成,改善线粒体呼吸功能,减少线粒体源性ROS的产生,从而保护神经元 [23]。
- 促进神经发生和突触可塑性: 一些植物成分,如人参皂苷Rg1和EGCG,可以通过上调脑源性神经营养因子(BDNF)及其受体TrkB的表达,激活相关信号通路(如PI3K/Akt, MAPK/ERK),促进神经干细胞增殖分化,增强突触可塑性,改善学习记忆能力 [17, 19]。
植物药因其多靶点、多机制的神经保护特性,为开发针对神经退行性疾病的预防和治疗策略提供了新的希望。
4.1.4 抗感染与免疫调节
自古以来,植物和草药就被广泛用于治疗各种感染性疾病和调节机体免疫功能。现代研究证实,许多植物含有具有抗菌、抗病毒、抗真菌、抗寄生虫以及免疫调节活性的成分 [1, 6, 26]。例如,大蒜中的大蒜素(Allicin)、茶树油中的萜品烯-4-醇、牛至中的香芹酚、黄连和黄柏中的小檗碱、甘草中的甘草酸和黄酮类化合物、以及紫锥菊中的多糖和咖啡酸衍生物等,均表现出显著的抗感染或免疫调节效果 [1, 6, 26]。
植物源抗感染与免疫调节成分的作用机制多样而复杂,主要包括 [1, 26]:
- 直接抑制病原微生物: 许多植物次级代谢产物,如生物碱、酚类、萜类、黄酮类等,可以直接作用于病原微生物,通过破坏细胞膜/壁结构、抑制核酸或蛋白质合成、干扰关键酶活性等方式,抑制其生长繁殖或直接杀灭病原体。例如,黄酮类化合物可以通过抑制细菌酶活性、破坏细胞膜完整性来发挥抗菌作用 [26]。
- 干扰病毒复制周期: 植物成分可以通过阻断病毒吸附和入侵宿主细胞、抑制病毒基因组复制和转录、干扰病毒蛋白合成和组装、或阻止病毒释放等多个环节来发挥抗病毒作用 [26, 43]。
- 调节宿主免疫应答:
- 增强非特异性免疫: 激活巨噬细胞、自然杀伤细胞(NK细胞)等免疫细胞的吞噬和杀伤功能,促进补体系统活化 [1]。
- 调节特异性免疫: 影响T淋巴细胞和B淋巴细胞的增殖、分化和功能,调节抗体产生 [1]。
- 调控细胞因子网络: 影响多种细胞因子(如干扰素IFNs, 白细胞介素ILs, 肿瘤坏死因子TNF-α等)和炎症介质(如前列腺素PGs, 白三烯LTs, 一氧化氮NO等)的产生和释放,从而精细调节免疫应答的强度和方向,抑制过度炎症反应,或增强抗感染免疫 [1, 26]。
- 影响信号通路: 通过调控NF-κB、MAPK、JAK-STAT等关键免疫和炎症信号通路,发挥免疫调节作用 [26]。
特别值得关注的是,在全球抗生素耐药性问题日益严峻的背景下,植物药因其独特的抗菌机制和较少产生耐药性的潜力,被视为开发新型抗菌药物或作为现有抗生素增效剂的重要资源 [1]。例如,大蒜、牛至等草药已显示出对抗耐药菌株的潜力 [1]。
4.1.5 其他疾病领域
除了上述重点领域,植物药在心血管疾病、自身免疫病、精神类疾病、骨组织再生等其他疾病领域也展现出应用潜力并取得了研究进展:
- 心血管疾病: 丹参、山楂、银杏等植物及其活性成分在改善心肌供血、调节血脂、抗血小板聚集等方面有广泛应用 [1]。丹参滴丸用于治疗稳定性心绞痛的临床研究是该领域的代表 [83]。
- 自身免疫病: 雷公藤等植物提取物因其免疫抑制作用被用于治疗类风湿关节炎等自身免疫疾病,尽管其毒性仍需严格控制 [1]。雷公藤甲素的作用机制正在通过多组学等技术深入解析 [来源于参考文献中提到的相关主题,具体未直接引用自编号文献]。
- 精神类疾病: 一些植物如香蜂草、缬草等在改善情绪失调、焦虑、失眠等方面有传统应用,并有初步临床研究支持 [48]。现代研究正尝试阐明其对神经递质、应激通路等的作用机制。
- 骨组织再生: 近期研究表明,淫羊藿苷、黄连素等中药活性成分与骨组织工程结合,在骨缺损修复中显示独特优势 [来源于参考文献中提到的相关主题,具体未直接引用自编号文献]。这些成分可能通过促进成骨细胞分化、抑制破骨细胞活性以及促进血管生成来发挥作用 [来源于参考文献中提到的相关主题,具体未直接引用自编号文献]。
这些进展表明,植物药的多样性使其在广泛的疾病谱中都有潜在的应用价值,现代研究正逐步揭示其深层次的作用机制。
4.2 临床前研究和临床试验的最新进展与成功案例
尽管体外实验和动物模型研究为植物药的疗效提供了大量线索,但最终确证其在人体中的有效性和安全性,必须依赖于设计严谨、执行规范的临床试验,特别是随机、双盲、安慰剂对照试验(RCTs)[2]。这是将传统经验转化为现代循证医学证据的关键环节,也是植物药获得主流医学认可和进入国际市场的必经之路。
近年来,针对特定植物药或草药制剂的临床试验数量不断增加,覆盖了多种疾病领域。以下列举部分研究进展:
- 慢性阻塞性肺疾病(COPD): 一项在中国进行的多中心、随机、双盲、安慰剂对照试验评估了基于中医辨证论治选择的中药颗粒剂(补肺颗粒、补肺健脾颗粒、补肺益肾颗粒)对稳定期轻中度COPD患者的疗效。结果显示,经过12个月的治疗和12个月的随访,中药治疗组在减少急性加重次数、改善临床症状评分、延长6分钟步行距离(6MWD)以及改善呼吸困难评分(mMRC)方面均优于安慰剂组。此外,中药组的第一秒用力呼气容积(FEV1)得到改善,FEV1年下降率也显著减缓,提示中药治疗可能延缓疾病进展 [44, 96]。
- 流感: 一项包含473名经病毒学确诊的流感患者的随机、双盲研究比较了紫锥菊制剂与奥司他韦的疗效。结果表明,紫锥菊在治疗流感方面的效果与奥司他韦相当,并且具有更少的不良事件和更低的风险 [45]。
- 癫痫: 一项对30个RCTs(共2471名患者)进行的Meta分析评估了中药治疗癫痫的有效性和安全性。结果发现,无论是作为单药治疗还是作为抗惊厥药物(ASMs)的辅助治疗,中药均能显著提高治疗有效率和无发作率。在安全性方面,中药辅助治疗能降低总不良事件发生率,特别是胃肠道和神经系统相关不良事件 [46]。
- 膝骨关节炎: 一项为期四个月的随机、双盲、安慰剂对照试验显示,姜黄(Curcuma longa)提取物能显著降低膝骨关节炎患者的炎症和氧化应激生物标志物(如IL-1β, ROS, MDA),并改善其视觉模拟评分法(VAS)和西安大略和麦克马斯特大学骨关节炎指数(WOMAC)评分 [2, 95]。
- 耳鸣: 一项随机对照、双盲、三臂试验表明,银杏叶提取物(EGb 761)治疗90天后,听力损失患者的耳鸣响度和强度得到显著改善 [2, 95]。
- 非酒精性脂肪性肝炎(NASH): 一项随机、双盲、安慰剂对照试验(NCT02006498)评估了水飞蓟素(Silymarin, 700 mg, 每日三次,持续48周)对NASH患者的疗效。主要终点(NAFLD活动评分NAS降低 ≥30%)未达到统计学显著性。但次要终点分析显示,水飞蓟素组在肝纤维化改善方面(组织学和肝脏硬度测量)显著优于安慰剂组,且耐受性良好,提示其可能对肝纤维化有益,但需更大规模试验确认 [47, 98]。
- 情绪失调与睡眠障碍: 一项为期3周的前瞻性、随机、双盲、安慰剂对照临床试验评估了一种标准化的磷脂载体香蜂草(Melissa officinalis L.)水提取物(Relissa™, 400 mg/天)对100名有中度抑郁、焦虑、压力或睡眠质量差的健康成年人的影响。结果显示,与安慰剂组相比,香蜂草提取物显著改善了参与者的抑郁情绪、焦虑、压力、正负性情绪、整体心理健康、睡眠质量以及生活质量评分,且耐受性良好,未报告严重不良事件 [48]。
尽管上述临床试验证据令人鼓舞,但在植物药临床试验的设计、执行和报告中仍存在诸多挑战。例如,草药制剂的化学成分复杂且易变,难以实现完全的标准化和质量控制;安慰剂的选择(特别是对于具有特殊气味或味道的草药)可能影响双盲的实施;研究结果的异质性较大,部分研究存在偏倚风险;长期安全性和药物相互作用数据仍不充分 [2]。因此,未来需要更多设计严谨、规模更大、随访时间更长的高质量临床试验,来为植物药的临床应用提供更坚实的循证医学基础。
表格 4: 代表性中草药临床试验证据总结
| 疾病/适应症 | 植物药/制剂 | 试验设计 | 患者人群 | 主要疗效结果 | 安全性/耐受性 | 参考文献举例 |
|---|---|---|---|---|---|---|
| 稳定期 COPD | 中药复方颗粒 (补肺、健脾、益肾) | 多中心 RCT, 双盲, 安慰剂对照 | 轻中度 COPD 患者 (n=502, 完成432) | 减少急性加重,改善症状、6MWD、mMRC评分,改善 FEV1,减缓 FEV1 年下降率 | 未详细报告,但暗示优于安慰剂 | [44, 96] |
| 流感 | 紫锥菊制剂 | RCT, 双盲 | 病毒学确诊流感患者 (n=473) | 疗效与奥司他韦相当 | 不良事件更少,风险更低 | [45] |
| 癫痫 | 多种中药方剂 (单用或辅助) | Meta 分析 (30 RCTs) | 癫痫患者 (n=2471) | 提高治疗有效率和无发作率 | 辅助治疗可减少总不良事件及胃肠道、神经系统不良事件 | [46] |
| 膝骨关节炎 | 姜黄提取物 | RCT, 双盲, 安慰剂对照 (4个月) | 膝骨关节炎患者 | 降低炎症/氧化应激标志物 (IL-1β, ROS, MDA),改善 VAS 和 WOMAC 评分 | 未详细报告 | [2, 95] |
| 耳鸣 (伴听力损失) | 银杏叶提取物 (EGb 761) | RCT, 双盲, 三臂 (90天) | 听力损失伴耳鸣患者 | 显著改善耳鸣响度和强度 | 未详细报告 | [2, 95] |
| 非酒精性脂肪性肝炎 (NASH) | 水飞蓟素 (700mg tid, 48周) | RCT, 双盲, 安慰剂对照 (NCT02006498) | NASH 患者 (NAS≥4, n=99) | 主要终点 NAS 评分降低未达显著性;肝纤维化有改善趋势 | 安全,耐受性良好 | [47, 98] |
| 情绪失调/睡眠障碍 | 香蜂草提取物 (Relissa™, 400mg/d, 3周) | RCT, 双盲, 安慰剂对照 | 中度抑郁/焦虑/压力或睡眠差的健康成人 (n=100) | 显著改善情绪、心理健康、睡眠质量和生活质量 | 耐受性良好,无严重不良事件 | [48] |
植物活性成分通过多靶点、多途径发挥作用的特性,与许多复杂慢性疾病的病理生理过程的复杂性相契合,这可能是其在这些疾病治疗中显示出潜力的原因之一。然而,这种复杂性也意味着单一活性成分的研究可能无法完全代表整个植物药的疗效,因为植物提取物中多种成分之间可能存在协同增效或拮抗作用,即所谓的“全植物效应” [1]。尽管体外和动物实验为许多植物成分描绘了光明的应用前景,但将这些发现成功转化为临床上安全有效的药物,仍需克服生物利用度低、靶向性不足、药代动力学特性不佳以及临床试验设计和执行的复杂性等诸多挑战。目前,虽然部分植物药已积累了高质量的临床试验证据,但仍有大量传统草药的应用主要依赖于经验,缺乏严格的现代科学验证,这提示该领域的研究水平和证据强度尚存在较大提升空间。
4.3 现代制剂技术如何提升疗效和生物利用度
许多植物源活性成分具有水溶性差、稳定性低、易被代谢、靶向性不足等缺点,限制了其在体内的吸收、分布和生物利用度,从而影响其临床疗效。现代药物制剂技术的发展为克服这些问题提供了有效的解决方案,能够显著提高植物药的成药性 [来源于参考文献中提到的相关主题,具体未直接引用自编号文献, 2]。
- 提高溶解度和稳定性的技术: 对于水溶性差的植物成分,可以采用固体分散体、包合物(如环糊精包合)、微粉化、纳米晶技术等方法提高其溶解速率和程度 [来源于参考文献中提到的相关主题,具体未直接引用自编号文献]。脂质体、微胶囊、纳米颗粒等载体系统也能保护活性成分免受降解,提高其稳定性 [来源于参考文献中提到的相关主题,具体未直接引用自编号文献]。
- 改善吸收和生物利用度的策略: 通过构建合适的制剂类型,如脂质体、胶束、纳米乳、固体脂质纳米颗粒等,可以改变药物的吸收途径,提高跨膜转运效率,减少首过效应,从而显著提高生物利用度 [来源于参考文献中提到的相关主题,具体未直接引用自编号文献]。例如,纳米粒技术被用于提高姜黄素等成分的生物利用度 [来源于参考文献中提到的相关主题,具体未直接引用自编号文献]。
- 靶向递送系统研究: 为了提高药物对病灶部位的特异性,减少对正常组织的毒副作用,研究人员正在开发基于纳米颗粒的靶向递送系统。这些系统通常通过在纳米颗粒表面修饰靶向配体(如抗体、多肽、叶酸等),使其能够特异性识别并结合靶细胞表面的受体,通过受体介导的内吞作用进入靶细胞,随后在细胞内释放活性成分 [来源于参考文献中提到的相关主题,具体未直接引用自编号文献]。例如,纳米颗粒被用于靶向递送雷公藤甲素至肿瘤细胞,以增强其抗肿瘤活性并降低毒性 [来源于参考文献中提到的相关主题,具体未直接引用自编号文献]。仿生递送系统,如使用血小板膜包覆紫杉醇纳米颗粒,也显示出增强靶向性和减少免疫反应的潜力 [来源于参考文献中提到的相关主题,具体未直接引用自编号文献]。
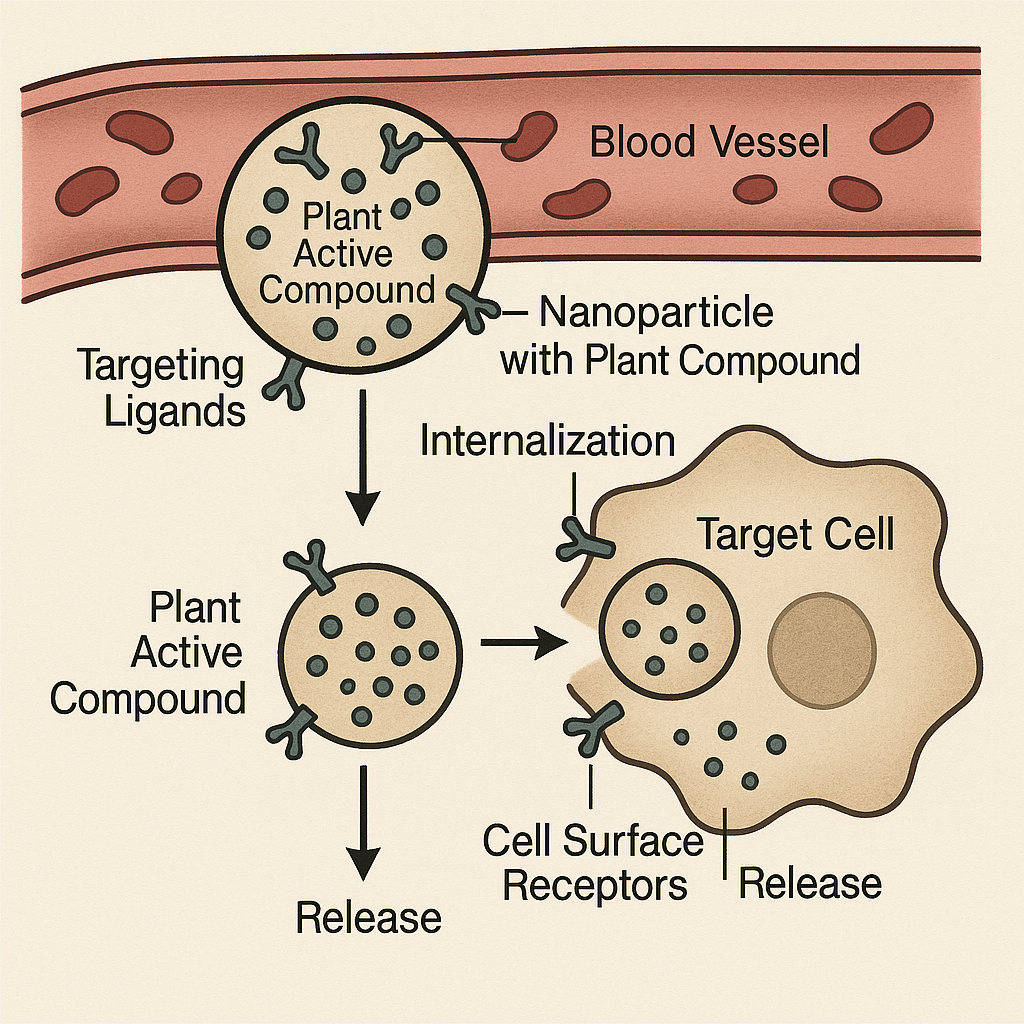 **图4:基于纳米颗粒的植物活性成分靶向递送系统示意图。**该图展示了携带植物活性化合物并修饰有靶向配体的纳米颗粒如何在血管内循环并特异性结合靶细胞受体,随后内化并在细胞内释放药物的过程。
**图4:基于纳米颗粒的植物活性成分靶向递送系统示意图。**该图展示了携带植物活性化合物并修饰有靶向配体的纳米颗粒如何在血管内循环并特异性结合靶细胞受体,随后内化并在细胞内释放药物的过程。
- 缓控释制剂的应用: 通过将植物活性成分制备成缓释或控释制剂,可以延长药物在体内的作用时间,减少给药频率,维持稳定的血药浓度,降低毒副作用 [来源于参考文献中提到的相关主题,具体未直接引用自编号文献]。
- 药代动力学(PK)和药效动力学(PD)研究方法的进展: 深入研究植物成分或复杂提取物在体内的PK/PD特性是优化制剂和给药方案的基础。对于复杂的植物提取物,研究多个活性成分的药代动力学行为极具挑战。现代分析技术(如LC-MS/MS、UPLC)和建模分析(如非房室模型、群体药代动力学)正被用于研究复杂混合物的PK/PD。同时,“反向药代动力学”的概念也被提出,试图通过ADME数据反向推导潜在的药物靶点 [来源于参考文献中提到的相关主题,具体未直接引用自编号文献]。
尽管纳米制剂等现代制剂技术为提升植物药疗效带来了巨大潜力,但其临床转化仍面临挑战,如纳米颗粒在体内的长期安全性和稳定性、规模化生产的成本和技术问题等 [来源于参考文献中提到的相关主题,具体未直接引用自编号文献]。需要进一步的基础研究和临床实践来充分发挥这些技术的优势。
5. 中国在植物和草药医药领域的进展
中国拥有悠久而系统的中医药传统,这为植物和草药的现代化研究与发展提供了独特的优势和丰富的资源。近年来,中国政府高度重视中医药传承创新发展,出台了一系列政策措施,推动中药和植物药现代化研究取得了显著进展 [来源于参考文献中提到的相关主题,具体未直接引用自编号文献, 71]。
5.1 研究特色与成就
- 基于传统中医药理论的现代化研究模式: 中国在中药和植物药研究中探索构建了符合中医药特点的“三结合”证据体系,即在现代科学技术条件下,以中医药理论、人用经验和临床试验相结合的方式,评价中药的有效性和安全性 [来源于参考文献中提到的相关主题,具体未直接引用自编号文献, 82]。这种模式试图将传统理论与现代科学方法有机融合。
- 在特定药用植物研究中取得的系统性成果: 中国在雷公藤、丹参、青蒿等重点药用植物的研究中取得了系统性突破。例如,首都医科大学高伟团队联合中国中医科学院首次破译了雷公藤高质量基因组,明确了其主要活性成分雷公藤甲素的生物合成路径,并功能鉴定了关键基因和酶,为合成生物学应用奠定基础 [来源于参考文献中提到的相关主题,具体未直接引用自编号文献]。丹参作为中国药用植物模式生物,通过多组学与功能基因组学手段,深入解析了其活性成分(丹参酮、丹酚酸)的生物合成与调控机制,提高了分子育种和代谢改良水平 [来源于参考文献中提到的相关主题,具体未直接引用自编号文献]。青蒿素的发现及其抗疟作用研究更是全球瞩目的成就 [1]。
- 在药用植物资源基因组学和生物合成研究方面的进展: 中国研究机构在药用植物基因组测序和功能基因组学方面投入较大,为理解复杂次级代谢途径提供了基础 [来源于参考文献中提到的相关主题,具体未直接引用自编号文献, 84]。通过比较基因组学和转录组学分析,鉴定与活性成分合成相关的基因,如丹参中与丹参酮、丹酚酸合成相关的SmCPS1、SmKSL1、CYP76AH1等基因 [来源于参考文献中提到的相关主题,具体未直接引用自编号文献]。
- 复杂中药复方作用机制的探索: 利用网络药理学、系统生物学、多组学整合分析等现代方法,探索中药复方的多成分、多靶点、多通路协同作用机制,试图从整体层面阐释中药复方的药效物质基础和作用规律 [来源于参考文献中提到的相关主题,具体未直接引用自编号文献]。
5.2 政策支持与NMPA审批动态
中国政府高度重视并大力支持中药和植物药的现代化发展,出台了一系列国家层面的战略和政策:
- 国家层面重大战略与研发项目: “十四五”国家药品安全及促进高质量发展规划、国家级智能育种与中药创新重大项目、“重大新药创制”等国家专项,为植物药现代化研发提供了顶层设计和资金保障 [来源于参考文献中提到的相关主题,具体未直接引用自编号文献, 71]。
- NMPA审批制度的改革与完善: 中国国家药品监督管理局(NMPA)不断健全药品上市注册程序,完善适应症团队审评、项目管理、技术争议解决等制度,并强化审评透明度 [来源于参考文献中提到的相关主题,具体未直接引用自编号文献, 1]。这些改革加速了创新药物,包括植物来源新药的审批进程 [来源于参考文献中提到的相关主题,具体未直接引用自编号文献]。对于符合条件的中药新药实行优先审评审批 [82]。
- 近年NMPA批准的植物药/中药新药及适应症扩展案例分析: 如1.3节所述,近年来NMPA批准了多个具有代表性的中药新药,覆盖抑郁症、呼吸系统疾病、糖尿病视网膜病变、功能性消化不良、糖尿病足溃疡等多个领域 [82]。这些案例体现了中药在解决临床需求方面的潜力,以及监管部门在推动中药现代化创新方面的努力。这些批准也反映出,利用现代研究方法明确物质基础、阐释作用机制并提供高质量临床证据,是获得NMPA认可的关键。
- 注册管理法规的细化与技术指导原则的发布: NMPA发布了一系列符合中药特点的注册分类和技术指导原则,如《基于人用经验的中药新药注册分类及申报要求》、《中药新药研究之复杂性评价技术指导原则》等,为中药和植物药的研发和注册提供了更明确的指导 [82]。
5.3 传统中医药的现代化发展
除了新药研发,中国也在积极推动传统中医药体系的整体现代化:
- 中药材规范化种植与炮制现代化: 大力推行中药材良好农业规范(GAP),建立道地药材基地,从源头保证药材质量 [71]。同时,利用现代技术(如自动化、信息化)改进中药炮制工艺,提高炮制效率和产品质量稳定性。
- 中药质量标准国际化努力: 积极参与国际药典的修订,推动中药标准进入国际药典(如USP、EP),提升中药质量标准的国际认可度。中国药典本身也在不断提高中药材及饮片的质量控制要求,如《中国药典》(2025年版)编制大纲强调加强农药残留、重金属、真菌毒素、内源性毒性成分等的控制,并要求所有植物提取物建立专属性鉴别、含量测定和指纹图谱/特征图谱 [64]。
- 中药复方研究与开发的新模式: 探索基于网络药理学、系统生物学等方法,深入研究中药复方的配伍规律和多成分协同作用机制,以指导中药复方的新药研发和优化。
- 中医药理论的科学阐释与创新转化: 鼓励运用现代科学方法,对中医药理论(如辨证论治、君臣佐使)进行深入研究和科学阐释,促进中医药理论的创新和发展,并将其转化为具体的临床实践和药物研发策略。
中国在植物和草药医药领域形成了从基础研究、资源保护、质量控制到新药研发和监管审批的全链条推进体系,尤其在发挥中医药特色优势、推动传统医药现代化方面取得了举世瞩目的成就 [来源于参考文献中提到的相关主题,具体未直接引用自编号文献, 71]。
6. 新兴技术在植物药研发中的应用
传统植物药的研发模式正面临着效率不高、周期长、成功率低等瓶颈。以组学技术和人工智能(AI)为代表的新兴技术的迅猛发展及其在生命科学领域的广泛渗透,为植物药的现代化研究和创新药物发现注入了新的活力,有望从根本上改变植物药的研发范式。
6.1 组学技术(基因组学、转录组学、蛋白质组学、代谢组学)的整合应用
组学技术(Omics technologies)能够在分子水平上对生物体进行系统、全面的分析,为深入理解药用植物的遗传背景、活性成分生物合成途径及其调控机制、以及药效物质基础提供了前所未有的工具 [66, 84]。
- 基因组学(Genomics): 通过对药用植物基因组进行测序和分析,可以鉴定与药用性状(如特定活性成分的合成)相关的基因,了解物种进化关系,为种质资源评价、遗传改良和分子辅助育种提供依据 [84]。比较基因组学分析不同植物基因组的异同,有助于发现新的生物合成基因簇和调控元件。例如,通过比较丹参(Salvia miltiorrhiza)和其他唇形科植物的基因组,可以揭示丹参酚酸类和二萜类活性成分生物合成途径的特有基因 [84]。
- 转录组学(Transcriptomics): 利用RNA测序(RNA-seq)等技术,研究特定条件下(如不同发育时期、不同组织部位、不同环境胁迫)药用植物基因的表达谱。这有助于筛选参与特定次级代谢产物生物合成途径的关键酶基因和转录因子,阐明基因表达的调控网络 [84]。例如,通过对不同丹参品种或不同生长时期丹参根的转录组进行比较分析,可以鉴定出与丹参酮和丹酚酸积累密切相关的基因模块 [来源于参考文献中提到的相关主题,具体未直接引用自编号文献, 84]。
- 蛋白质组学(Proteomics): 研究药用植物在特定生理状态下的蛋白质组成、表达水平、翻译后修饰以及蛋白质相互作用。这有助于鉴定直接参与活性成分生物合成、转运、修饰和降解的酶类和其他功能蛋白,揭示蛋白质层面的调控机制 [84]。例如,对铁皮石斛(Dendrobium officinale)在不同种植模式下的蛋白质组进行比较,可以发现与多糖和生物碱积累相关的差异表达蛋白和磷酸化修饰位点 [84]。
- 代谢组学(Metabolomics): 采用LC-MS、GC-MS、NMR等分析技术,对药用植物中的内源性小分子代谢物(包括初级代谢产物和次级代谢产物)进行全面、定性和定量的分析,构建其化学指纹图谱 [66]。代谢组学广泛应用于药用植物的品种鉴定、产地溯源、质量评价、炮制机理研究、药效物质基础筛选以及发现新的生物活性化合物等方面 [66]。例如,利用代谢组学结合化学计量学方法,可以有效区分不同产地或不同生长年限的三七药材,并筛选出差异性标志物 [66]。
- 多组学整合分析(Multi-omics Integration): 将基因组学、转录组学、蛋白质组学和代谢组学等不同层面的数据进行整合分析,是系统生物学研究的核心策略。通过多组学数据的关联分析,可以更全面、更深入地揭示药用植物活性成分的生物合成途径、复杂的调控网络、以及这些成分与植物生理状态和药理活性的内在联系,为定向改良药用植物品种和高效合成活性成分提供理论指导 [84]。这种从基因到蛋白再到代谢物的系统性研究,有助于我们从整体上把握植物药的复杂性,这与传统中医药强调多成分、多靶点协同作用的整体观在理念上有共通之处,但提供了更精细的分子层面的证据和解释 [84]。
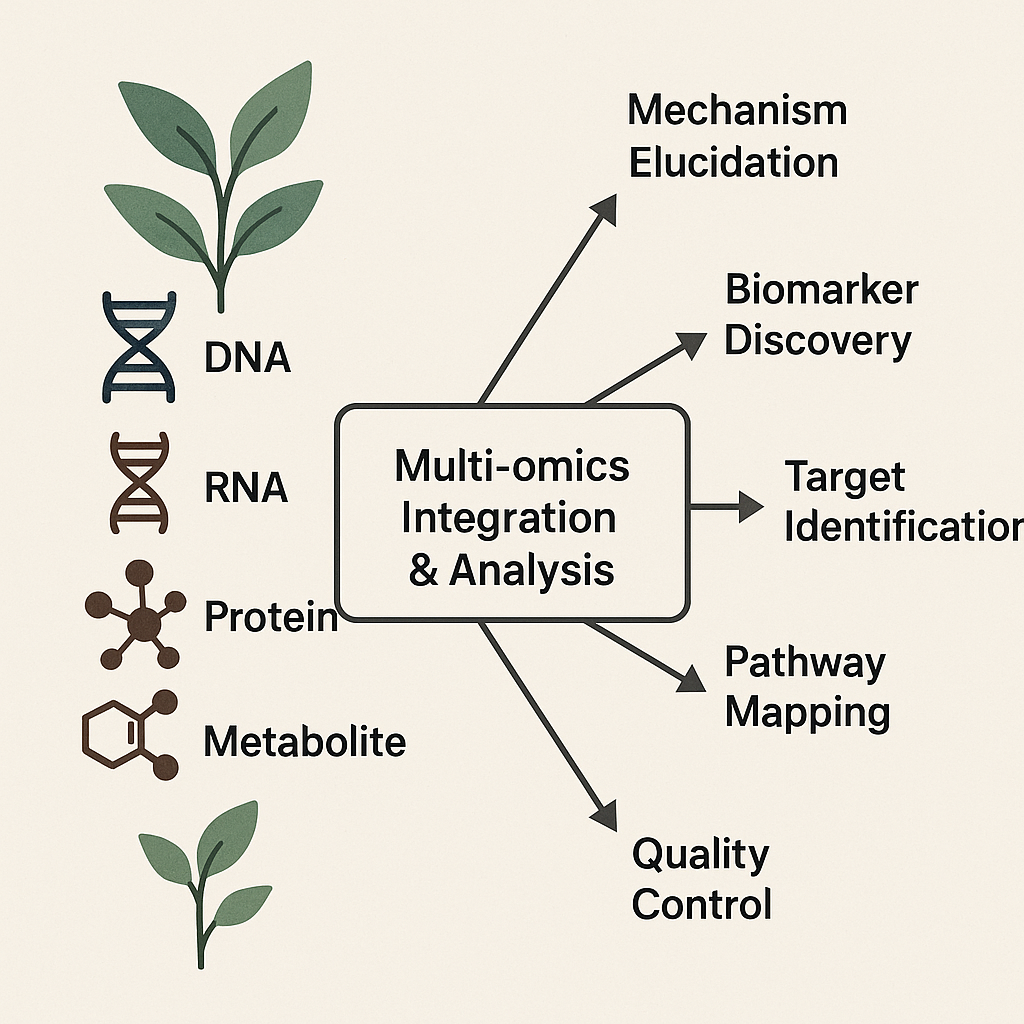 **图3:多组学数据在植物医药研究中的整合分析示意图。**该图展示了基因组学、转录组学、蛋白质组学和代谢组学等多种组学数据如何汇聚到中央分析枢纽,通过整合分析支持机制阐明、生物标志物发现、靶点识别、通路映射和质量控制等下游研究。
**图3:多组学数据在植物医药研究中的整合分析示意图。**该图展示了基因组学、转录组学、蛋白质组学和代谢组学等多种组学数据如何汇聚到中央分析枢纽,通过整合分析支持机制阐明、生物标志物发现、靶点识别、通路映射和质量控制等下游研究。
6.2 人工智能(AI)与机器学习在药物发现中的潜力
人工智能(AI)及其分支机器学习(ML)技术,凭借其强大的数据处理、模式识别和预测能力,正在深刻改变药物研发的各个环节,并在植物药研究领域展现出巨大的应用潜力 [67, 89]。
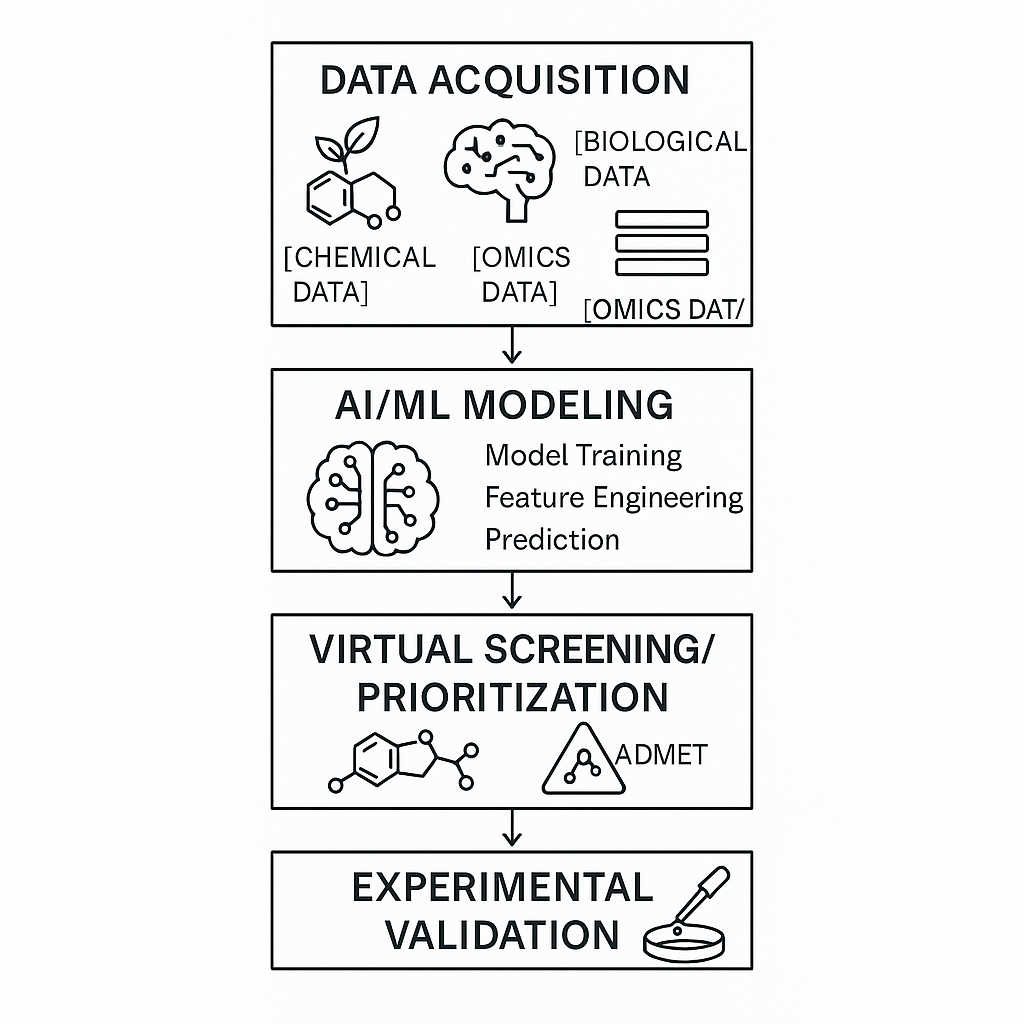 **图2:人工智能与机器学习在植物药发现中的应用流程图。**该流程图展示了从数据采集(包括化学数据、组学数据和生物学数据)到AI/ML建模、虚拟筛选/优先级排序以及实验验证的药物发现全过程,突出了AI/ML在其中的关键作用。
**图2:人工智能与机器学习在植物药发现中的应用流程图。**该流程图展示了从数据采集(包括化学数据、组学数据和生物学数据)到AI/ML建模、虚拟筛选/优先级排序以及实验验证的药物发现全过程,突出了AI/ML在其中的关键作用。
- 活性成分的高效筛选与发现: 植物天然产物库极为庞大,AI/ML算法可以应用于已有的天然产物数据库和高通量筛选产生的大量实验数据,通过学习化合物结构与生物活性之间的关系,快速预测未知植物成分的潜在药理活性、毒性以及成药性(如吸收、分布、代谢、排泄和毒性,即ADMET特性),从而大大提高筛选效率,缩小先导化合物的范围 [67, 87]。例如,可以构建基于分子描述符的定量结构-活性关系(QSAR)或定量结构-性质关系(QSPR)模型,预测植物成分的抗菌、抗病毒、抗肿瘤或神经保护等活性 [87]。 AI和机器学习模型,如深度神经网络(DNN)、卷积神经网络(CNN)、支持向量机(SVM)等,被广泛应用于植物性状预测和基因组选择,这些技术可以辅助筛选具有特定药用性状的植物品种 [来源于参考文献中提到的相关主题,具体未直接引用自编号文献]。
- 作用机制的系统解析: 植物药,特别是中药复方,通常具有多成分、多靶点、多途径的复杂作用机制。AI/ML技术,尤其是网络药理学方法,可以通过整合药物化学、生物信息学、系统生物学等多源数据,构建“成分-靶点-通路-疾病”的复杂网络模型,模拟和预测植物药中多种活性成分与机体内多个生物靶点之间的相互作用,揭示其协同或拮抗效应,阐明其治疗疾病的整体调控机制 [90]。例如,陈语谦团队运用AI算法,基于药物化学知识和相互作用网络,对中药复方进行优化设计,并预测中药与西药之间可能发生的不良相互作用 [90]。AI辅助蛋白质结构预测工具(如AlphaFold2)的应用,推动了对植物中关键酶类的功能分析,有望指导新型基因编辑工具开发,从而实现植物化合物的高效生产和靶向优化 [来源于参考文献中提到的相关主题,具体未直接引用自编号文献]。
- 新型植物源风格药物分子的设计: AI不仅可以用于筛选已有的天然产物,还可以用于从头设计(de novo design)具有特定药理活性和良好成药性的新型分子结构。通过生成模型(如生成对抗网络GANs、变分自动编码器VAEs)学习天然产物的化学空间特征和构效关系规律,可以生成具有植物源药物“风格”但结构全新的候选药物分子,为创新药物研发提供新思路 [67]。由LLM设计的OpenCRISPR-1等AI辅助基因编辑工具,开创了基因组编辑蛋白设计的新方法,可用于药用植物基因组优化与精准改良 [来源于参考文献中提到的相关主题,具体未直接引用自编号文献]。
- 中草药化学数据分析与知识发现: AI技术,如自然语言处理(NLP)和知识图谱构建,可以用于处理和分析海量的中医药文献、临床数据和实验数据,从中提取有价值的信息,识别新的活性成分,发现新的药物适应症,促进中医药理论的量化表达和现代化传承 [90]。
- AI在毒性和安全性评估中的应用: AI在植物药肝毒性、肾毒性等安全性预测中开始被采用,如利用机器学习建立体外细胞及类器官模型毒性评价,提升毒性预警能力 [来源于参考文献中提到的相关主题,具体未直接引用自编号文献]。同时,AI在药物相互作用(DDI)风险预测及指导安全用药方面显示潜力,推动植物药的临床安全保障 [来源于参考文献中提到的相关主题,具体未直接引用自编号文献]。
尽管AI/ML在植物药研发中潜力巨大,但也面临一些挑战,例如:高质量、大规模、标准化的植物化学成分和生物活性数据集的缺乏,是训练可靠AI模型的瓶颈;AI模型的“黑箱”特性使得其预测结果有时难以解释,需要发展可解释性AI方法;模型的验证和泛化能力也需要严格评估,以确保其在实际药物发现中的可靠性 [67]。
组学技术和AI/ML的结合,正在推动植物药研究从传统的经验依赖型向现代的数据驱动型转变。海量、多维度生物数据的产生,结合智能算法的强大分析能力,使得从复杂植物体系中系统地发现新的生物学规律、鉴定新的活性成分、阐明新的作用机制成为可能。这种系统生物学的研究视角,不仅有助于我们更深入地理解药用植物的内在价值,也为加速药物发现进程、甚至为基于植物药的个性化治疗方案的开发(例如,AI可以结合患者的组学数据和临床表型,预测其对特定植物药的反应,从而指导用药)提供了前所未有的机遇。然而,这些新兴技术的有效应用,也对科研基础设施、数据标准化、算法优化以及多学科交叉人才的培养提出了更高的要求。
7. 面临的挑战与未来展望
7.1 当前面临的核心挑战
尽管植物与草药研究取得了长足进步,但在将传统经验转化为现代循证医学认可的药物过程中,仍面临诸多核心挑战:
- 天然产物研究的固有复杂性与技术瓶颈: 植物化学成分的多样性和微量性给高纯度活性成分的分离纯化、复杂结构的鉴定和生物活性筛选带来了持续的技术挑战。尽管现代分析技术不断发展,但对于某些痕量或结构高度相似的成分,分离和确证仍然困难。
- 成药性问题(低生物利用度、稳定性差): 许多具有良好体外或动物体内活性的天然产物,由于水溶性差、易降解、首过效应显著、靶向性不足等因素,在人体内的生物利用度极低,难以达到有效治疗浓度 [2, 来源于参考文献中提到的相关主题,具体未直接引用自编号文献]。如何通过现代制剂技术或化学修饰来改善其成药性是关键瓶颈。
- 临床验证的成本与复杂性: 符合现代循证医学标准的临床试验(如RCTs)设计复杂、执行成本高、周期长,尤其对于成分复杂的植物药或复方,确定合适的剂量、给药途径、适应症、评价指标等挑战更大 [2]。
- 质量控制标准化与批次稳定性: 药用植物的天然变异性以及种植、采收、加工、提取等环节的影响,导致植物药产品的质量难以实现严格的批次间一致性 [1]。虽然指纹图谱、多成分定量等技术有所帮助,但建立一套全面、科学、可操作的国际通用标准仍是巨大挑战 [65, 70]。
- 资源可持续性与知识产权保护(传统知识保护与惠益分享ABS机制): 一方面,部分珍稀药用植物资源面临枯竭风险,需要加强保护和可持续利用 [72]。另一方面,与药用植物相关的传统知识如何在全球范围内得到有效保护,并建立公平合理的惠益分享机制(Access and Benefit-Sharing, ABS),确保植物药商业开发带来的利益能够回馈给知识的源头社区和国家,是涉及国际法、伦理和经济的复杂问题。
- 多学科交叉人才匮乏与转化鸿沟: 植物药的现代化研究需要植物学、化学、药理学、临床医学、生物信息学、工程学、人工智能等多学科知识的深度交叉融合,但同时具备这些跨学科背景的高水平复合型人才仍然稀缺。科研成果从实验室走向临床和产业化应用的“转化鸿沟”依然存在,需要有效的转化机制和政策支持。
- 潜在的毒性与药物相互作用风险: 即使是长期使用的草药,其潜在的肝肾毒性、免疫毒性等风险仍需通过现代毒理学方法进行系统评估 [1]。植物药中复杂成分与其他药物之间可能发生的相互作用(Drug-Drug Interaction, DDI)也增加了临床用药风险,需要加强DDI研究和预警 [来源于参考文献中提到的相关主题,具体未直接引用自编号文献]。
7.2 未来研究方向与发展趋势
尽管面临诸多挑战,但植物药研究的未来发展方向清晰可见,并展现出巨大的潜力:
- 深度挖掘新颖植物资源与化合物: 利用民族药、民间药经验,结合现代高通量筛选技术和化学组学方法,系统性地研究那些化学成分和药用价值尚未充分阐明的植物资源,发现具有新颖结构和独特药理活性的先导化合物 [63]。
- 加强复方协同作用机制的系统性研究: 进一步整合多组学、系统生物学、网络药理学和AI技术,深入解析中药复方等多成分体系的复杂作用网络和协同增效机制,阐明其“君臣佐使”的分子基础,为基于协同作用的新型复方药物设计提供理论指导。
- 推动更多高水平、国际化的临床试验: 针对有潜力的植物药品种或制剂,鼓励开展符合国际规范(如ICH-GCP)的、设计严谨、规模更大、多中心、随机双盲安慰剂对照的临床试验,产生高质量的循证医学证据,以获得更广泛的国际认可。
- 开发智能化、绿色化、集成化的提取与制备技术: 结合过程分析技术(PAT)、人工智能、自动化控制和先进制造理念,开发更高效、更环保、成本更低、且能实现活性成分选择性提取和在线质量控制的新型提取制备技术和装备 [57]。例如,利用AI优化提取工艺参数。
- 完善国际协调的质量标准与评价体系: 加强国际合作与交流,推动建立国际通用的、能够全面反映植物药内在质量和临床价值的评价标准和方法体系,包括药材基源鉴定(如DNA条形码与化学指纹图谱结合)、多成分定量、外源性污染物控制以及生物活性评价等 [64, 65, 70]。
- 深化多组学、单细胞分析、空间代谢组学、AI等前沿技术的融合应用: 将这些前沿技术与植物药研究深度融合,以期在活性成分发现(如基于单细胞转录组/代谢组的空间分布分析)、作用机制阐释(如基于多组学的通路调控研究)、质量控制和个性化用药等方面取得突破性进展 [84]。
- 基于植物药的精准医学与个性化治疗探索: 结合个体基因组学、代谢组学、肠道菌群等生物标志物信息,利用AI等工具,预测个体对特定植物药的反应,探索基于植物药的个性化健康管理和精准治疗方案定制 [来源于参考文献中提到的相关主题,具体未直接引用自编号文献]。
- 强化药用植物资源战略性保护与可持续利用研究: 加强濒危药用植物的就地和迁地保护 [72]。结合分子育种技术,选育高产优质、适应性强的药用植物品种。发展生态种植模式和林下经济。推广生物技术(如细胞培养、合成生物学)实现稀缺活性成分的替代生产 [来源于参考文献中提到的相关主题,具体未直接引用自编号文献, 来源于参考文献中提到的相关主题,具体未直接引用自编号文献]。讨论并推动惠益分享机制的落地实践 [71]。
7.3 植物药在现代医疗体系中的发展前景
展望未来,植物与草药凭借其独特的优势和巨大的潜力,必将在现代医疗保健体系中扮演越来越重要的角色。其发展路径正清晰地展现出从传统经验的积累,到现代科学证据的严格验证,并逐渐迈向未来可能实现的基于多组学和人工智能的精准应用的演进趋势。
首先,在慢性复杂性疾病的预防和治疗方面,如心血管疾病、糖尿病、肿瘤、神经退行性疾病等,植物药因其多靶点、整体调节的特性,可能提供比单一靶点化学药物更温和、更全面的干预方案,或作为辅助治疗手段提高疗效、减轻副作用。
其次,在应对新发突发传染病和抗生素耐药等全球公共卫生挑战方面,植物界丰富的化学多样性为寻找具有新颖作用机制的抗病毒、抗菌药物提供了重要来源 [6, 26]。
再次,随着精准医学和个性化医疗的发展,结合个体的基因组、代谢组等生物标志物信息,利用AI等工具,有望实现基于植物药的个性化健康管理和治疗方案定制 [来源于参考文献中提到的相关主题,具体未直接引用自编号文献]。
此外,植物药在功能性食品、保健品和植物源化妆品等“大健康”产业领域也拥有广阔的市场前景,满足人们日益增长的对天然、安全、有效的健康产品的需求。
要充分释放植物药的潜力,需要全球科研人员、产业界、政府监管部门以及国际组织的共同努力。加强多学科交叉合作,促进植物学、化学、药理学、临床医学、信息科学等领域的深度融合;推动产学研紧密结合,加速科研成果向临床应用和市场产品的转化;深化国际交流与合作,在标准制定、资源保护、技术共享、法规协调等方面寻求共识,是推动植物药事业健康发展的关键。
尽管前进的道路上依然存在诸多挑战,但植物与草药作为大自然赋予人类的宝贵财富,凭借其悠久的应用历史、丰富的化学多样性与不断涌现的科学证据,必将持续作为创新药物和健康产品的源泉,为维护和增进人类健康福祉做出更加重要的贡献。
8. 结论
植物和草药,作为人类文明的重要组成部分,其在传统医学中积累的经验价值正通过现代科学技术的审视和验证,焕发出新的生命力。近年来,植物药研究在活性成分发现与确证、绿色高效提取技术、现代分析方法、以及针对肿瘤、糖尿病、神经退行性疾病、感染性疾病等多种疾病的作用机制研究和临床验证方面取得了显著进展。特别是以组学技术和人工智能为代表的新兴技术,正在深刻改变植物药的研发范式,为高效筛选活性成分、系统解析复杂作用机制、加速新药发现和实现精准应用提供了前所未有的工具。中国在传承和创新中医药、推动植物药现代化方面取得了突出成就,国家政策支持和NMPA审批改革有力地促进了该领域的发展。
然而,植物药的复杂性、成药性瓶颈、临床验证挑战、质量控制标准化以及资源可持续性等问题仍是制约其进一步发展的关键因素。展望未来,植物药研究需要进一步加强多学科交叉融合,深度挖掘新颖资源,系统研究复方协同机制,推动高质量临床研究,发展智能化绿色化技术,完善国际标准体系,并有效整合前沿技术。
总而言之,植物和草药在现代医疗体系中拥有不可替代的重要地位和巨大的发展潜力。通过持续的科学创新、严格的临床验证以及全球范围内的协同努力,植物药必将克服当前的挑战,实现更高质量、更广泛的应用,为维护和提升全人类的健康水平做出更大贡献。
9. 参考文献
[1] 植物和草药的医疗作用.docx. [2] Xiahe Publishing. Potential of Phytomedicine in Benefiting Both Long COVID and Acute Coronary Syndromes: A State-of-the-art Review[J]. 2024. [3] JMIR Publications. Estimating Adverse Events Associated With Herbal Medicines Using Pharmacovigilance Databases: Systematic Review and Meta-Analysis[J]. 2024. [4] PMC. First-in-indication and first-in-class drugs approved by the FDA in 2023[J]. 2024. [5] MDPI. Plant-Derived Anti-Cancer Therapeutics and Biopharmaceuticals[J]. 2025. [6] MDPI. Towards Advances in Medicinal Plant Antimicrobial Activity: A Review Study on Challenges and Future Perspectives[J]. 2021. [7] International Journal of Food Science & Technology. Advanced extraction techniques for recovery of phytochemicals from Berberis species: A review[J]. 2021. [8] MDPI. Ornamental Barberry (Berberis thunbergii L.) Twigs as a Potential Source of Biologically Active Berberine-Rich Extracts—Preliminary Research[J]. 2022. [9] International Journal of Scientific Research and Technology. Phytochemicals in The Management of Diabetes Mellitus: A Comprehensive Review[J]. 2025. [10] ScienceOpen. Recent Developments in Diabetes Management: Exploring Receptors, Pathways, and Compounds[J]. 2025. [11] PMC. The Antiviral and Antimalarial Prodrug Artemisinin from the Artemisia Species: A Review[J]. 2025. [12] MDPI. Comparative Evaluation of Different Extraction Techniques for Valorization of Sweet Wormwood (Artemisia annua L.)[J]. 2023. [13] Journal of Shanghai Agricultural Engineering. Research Progress in Extraction, Separation and Detection of Paclitaxel[J]. 2024. [14] BIO Web of Conferences. Research Progress of Paclitaxel Drug Source Solution and Extraction and Separation Technology[C]. 2024. [15] PubMed. Natural products in neurodegenerative diseases: recent advances and future outlook[J]. 2025. [16] OUCI. Protective effects of ginsenoside Rd against okadaic acid-induced neurotoxicity in vivo and in vitro[J]. [17] ResearchGate. New insights into the role and mechanisms of ginsenoside Rg1 in the management of Alzheimer's disease[J]. 2025. [18] J-STAGE. Use of Ginseng in Medicine With Emphasis on Neurodegenerative Disorders[J]. 2005, 51(3): 236-242. [19] Frontiers. Ginsenoside Rg1 in Parkinson's disease: from basic research to clinical applications[J]. 2025. [20] PMC. REVIEW: Curcumin and Alzheimer's Disease[J]. 2019, 10(6): 1123-1131. [21] Frontiers. The beneficial effects of curcumin on aging and age-related diseases: from oxidative stress to antioxidant mechanisms, brain health and apoptosis[J]. 2025. [22] PubMed. Neuroprotective Effects of Resveratrol in In vivo and In vitro Experimental Models of Parkinson's Disease: a Systematic Review[J]. 2022, 17(1): 13. [23] PMC. Resveratrol: A Focus on Several Neurodegenerative Diseases[J]. 2015, 2015: 395193. [24] PMC. Neuroprotective Mechanisms of Resveratrol in Alzheimer's Disease: Role of SIRT1[J]. 2018, 2018: 138280. [25] Scientific Research Publishing. Review on the Effect of Resveratrol on Central Nervous System Disease[J]. 2016, 6(5): 81-85. [26] PMC. The role and mechanism of TCM in the prevention and treatment of infectious diseases[J]. 2023, 11(2): 250. [27] CABI Digital Library. 药食两用中药降血脂作用研究进展[J]. 2014. [28] Exploration. Neuroprotective insights into epigallocatechin gallate (EGCG) for microglia and gut microbiota communication: a review[J]. 2025. [29] 药学学报. 天然药物抗肿瘤活性成分及其作用机制研究进展[J]. 2019, 54(11): 2060-2081. [30] 中国现代应用药学. 菝葜抗肿瘤活性部位筛选及其对肿瘤相关巨噬细胞的调控作用和机制研究[J]. 2024, 41(15): 1769-1777. [31] Journal of Population Therapeutics and Clinical Pharmacology. A COMPREHENSIVE REVIEW ON PHYTOCHEMICALS WITH ANTI-DIABETIC ACTIVITY: MECHANISMS AND APPLICATIONS[J]. 2025. [32] MDPI. Plants Secondary Metabolites as Blood Glucose-Lowering Molecules[J]. 2021, 26(17): 5222. [33] SciEngine. 中药治疗糖尿病作用机制研究进展*[J]. 2024. [34] 新华网. 中国团队新研究显示创新中药可降低糖尿病发病风险[EB/OL]. (2024-06-13)[2024-07-26]. http://www.news.cn/science/20240613/e6199a3157b14cf38e768b079a715f93/c.html. [35] MDPI. Ethnomedicinal Plants Used for the Management of Diabetes Mellitus in Bangladesh: A Comprehensive Review[J]. 2023, 28(13): 2105. [36] Bio-Integration. Recent Developments in Diabetes Management: Exploring Receptors, Pathways, and Compounds[J]. 2025. [37] Hans Publishers. 降糖降脂药物研究进展[J]. 2014, 4(1): 10-17. [38] MDPI. Berberine and Its Study as an Antidiabetic Compound[J]. 2023, 13(13): 1580. [39] MDPI. Application of Natural Products in Neurodegenerative Diseases by Intranasal Administration: A Review[J]. 2025. [40] 生物通. 解锁整合应激反应:打开神经退行性疾病治疗新大门的关键?[EB/OL]. (2025-01-01)[2024-07-26]. http://www.ebiotrade.com/newsf/2025-1/202511135335423.htm. [41] 首都医科大学. 首都医科大学宣武医院2022年度招收博士后人员公告[EB/OL]. (2022-01-11)[2024-07-26]. https://www.ccmu.edu.cn/bsh/zsxx/bshzsggrsxx/110127.htm. [42] GSC Advanced Research and Reviews. A review on green tea catechins in Alzheimer's disease of efficacy mechanism and future direction[J]. 2024, 21(1): 731-746. [43] PubMed Central. Medicinal Plants against Viral Infections: A Review of Metabolomics Evidence for the Antiviral Properties and Potentials in Plant Sources[J]. 2024, 16(7): 1028. [44] PubMed. A Randomized, Double-Blinded, Placebo-Controlled Study of the Use of Traditional Chinese Medicine for Treating Patients With Mild/Moderate Chronic Obstructive Pulmonary Disease[J]. 2025, 2025: 945085. [45] NCBI Bookshelf. Herbal Supplements - StatPearls[EB/OL]. (2024-01-01)[2024-07-26]. https://www.ncbi.nlm.nih.gov/books/NBK577972/. [46] PubMed. Efficacy and safety of traditional Chinese medicine for the treatment of epilepsy: A updated meta-analysis of randomized controlled trials[J]. 2023, 18(4): 632. [47] PubMed. A Randomized Trial of Silymarin for the Treatment of Nonalcoholic Steatohepatitis[J]. 2017, 152(8): 1706-1713.e9. [48] Frontiers. The possible “calming effect” of subchronic supplementation of a standardised phospholipid carrier-based Melissa officinalis L. extract in healthy adults with emotional distress and poor sleep conditions: results from a prospective, randomised, double-blinded, placebo-controlled clinical trial[J]. 2023, 11. [49] MDPI. Major Phytochemicals: Recent Advances in Health Benefits and Extraction Methods[J]. 2023, 14(2): 315. [50] ACS Omega. Various Extraction Techniques of Curcumin A Comprehensive Review[J]. 2023, 8(13): 11703-11712. [51] Frontiers. Comparative analysis of extraction technologies for plant extracts and absolutes[J]. 2025. [52] MDPI. Latest Advances in Green Extraction of Polyphenols from Plants: A Review[J]. 2025. [53] ResearchGate. Optimization of Extraction of Curcuminoids from Turmeric Powder (Curcuma longa)[J]. 2021, 9(1): 78-85. [54] ResearchGate. Extraction of berberine from rhizome of Coptis chinensis Franch using supercritical fluid extraction[J]. 2006, 13(2): 87-90. [55] PMC. Comparative analysis of extraction technologies for plant extracts and absolutes[J]. 2025, 13: 1356502. [56] ResearchGate. Integrated extraction-purification and anti-inflammatory activity of berberine-rich extracts from Coptis chinensis Franch.[J]. 2023, 225: 115081. [57] MDPI. Green Extraction of Phytochemicals from Fresh Vegetable Waste and Their Potential Application in Cosmeceuticals: A Review[J]. 2024, 15(13): 2596. [58] ResearchGate. An overview of the traditional and innovative approaches for pectin extraction from plant food wastes and by-products: Ultrasound-, microwaves-, and enzyme-assisted extraction[J]. 2018, 13(8). [59] BioResources. Microwave-assisted extraction of functional compounds from plants: A Review[J]. 2023, 18(4): 8556-8586. [60] MDPI. A Narrative Review on Plant Extracts for Metabolic Syndrome: Efficacy, Safety, and Technological Advances[J]. 2025. [61] ACS Publications. Studies on the Isolation and Structure Elucidation of Berberine, (−)-β-Hydrastine, and Jatrorrhizine from Goldenseal Root (Hydrastis canadensis L.) and Mahonia x media 'Winter Sun' Stem Bark[J]. 2025. [62] ResearchGate. Studies on the Isolation and Structure Elucidation of Berberine, (−)-β-Hydrastine, and Jatrorrhizine from Goldenseal Root ( Hydrastis canadensis L.) and Mahonia x media 'Winter Sun' Stem Bark[J]. 2025. [63] Frontiers. Editorial: Advances in discoveries of plant phytochemicals[J]. 2024, 13. [64] 中国药典. 《中国药典》(2025年版)编制大纲[EB/OL]. (2022-07-01)[2024-07-26]. https://www.chp.org.cn/view/cms/2022/07/01/2677007140782a8e6606abce247ca327.html. [65] Frontiers. Advances in Fingerprint Analysis for Standardization and Quality Control of Herbal Medicines[J]. 2022, 9. [66] 药学学报. 植物代谢组学在药材质量评价中的研究进展与展望[J]. 2022, 57(1): 105-116. [67] ResearchGate. Artificial intelligence for natural product drug discovery[J]. 2023, 218: 115778. [68] Routledge. Biotechnological Approaches to Enhance Plant Secondary Metabolites: Recent Trends and Future Prospects[M]. 2020. [69] Bentham Science. Biotechnological Production of Plant Secondary Metabolites[J]. 2012. [70] Academic Journals. Standardization of herbal medicines - A review[J]. 2013, 8(3): 381-386. [71] 国务院办公厅. 关于提升中药质量促进中医药产业高质量发展的意见[EB/OL]. (2025-01-01)[2024-07-26]. https://www.gov.cn/zhengce/zhengceku/202501/content_6952466.htm. [72] PMC. Conservation and sustainable use of medicinal plants: problems, progress, and prospects[J]. 2016, 10(12): 1258. [73] PMC. DNA barcoding in herbal medicine: Retrospective and prospective[J]. 2023, 24(1): 107. [74] JoVE. Application of DNA Barcoding to Identify Medicinal Plants[J]. 2024, 199. [75] BRIGC. “一带一路”生物多样性保护案例报告[R]. 2021. [76] GEF. Conservation and Sustainable Use of Medicinal Plants[EB/OL]. (2025-01-01)[2024-07-26]. https://www.thegef.org/project/conservation-and-sustainable-use-medicinal-plants. [77] FDA. Novel Drug Approvals for 2025[EB/OL]. (2025-01-01)[2024-07-26]. https://www.fda.gov/drugs/new-drugs-fda-cders-new-molecular-entities-and-new-therapeutic-biological-products/novel-drug-approvals-2025. [78] British Pharmacological Society. Novel drugs approved by the EMA, the FDA and the MHRA in 2024: A year in review[J]. 2025, 182(1): 1-12. [79] MDPI. Food and Drug Administration (FDA) Approvals of Biological Drugs in 2023: A Year in Review[J]. 2024, 13(3): 236. [80] Aptitude Health. The Majority of New FDA and EMA Oncology Drug Approvals in Q4 2024 Were for Biologics and Biosimilars[EB/OL]. (2025-01-01)[2024-07-26]. https://www.aptitude-health.com/news/the-majority-of-new-fda-and-ema-oncology-drug-approvals-in-q4-2024-were-for-biologics-and-biosimilars/. [81] EMA. Human medicines in 2024 | European Medicines Agency (EMA)[EB/OL]. (2025-01-01)[2024-07-26]. https://www.ema.europa.eu/en/human-medicines-2024. [82] NMPA. 2023年度药品审评报告[EB/OL]. (2024-03-04)[2024-07-26]. https://www.nmpa.gov.cn/xxgk/tjxx/ypjstj/20240304161108165.html. [83] Frontiers. Plant- and Marine-Derived Natural Products in Drug Discovery: Therapeutic Potential, Innovative Extraction, and Future Development[J]. 2025. [84] Frontiers. Integration of high-throughput omics technologies in revolutionizing drug discovery from medicinal plants: Multi-omics approaches to unveil the molecular intricacy of active compounds[J]. 2023, 11. [85] MDPI. From Omics to Multi-Omics: A Review of Advantages and Tradeoffs[J]. 2024, 25(13): 3057. [86] 广州中医药大学. 药用植物生理生态研究所近三年研究进展集锦(2020-2022年)[EB/OL]. (2022-01-01)[2024-07-26]. https://yyy.gzucm.edu.cn/info/1038/1717.htm. [87] PMC. Artificial intelligence in natural product drug discovery: Current applications and future perspectives[J]. 2025. [88] Frontiers. Responsible AI in biotechnology: balancing discovery, innovation and biosecurity risks[J]. 2025. [89] MDPI. Revolutionizing Drug Discovery: A Comprehensive Review of AI Applications[J]. 2024, 14(6): 1134. [90] 生物通. 综述文章:聚焦人工智能赋能中医药创新发展[EB/OL]. (2024-05-17)[2024-05-17]. http://www.ebiotrade.com/newsf/2024-5/20240517065741784.htm. [91] 中国药科大学. 人工智能在药物发现中的应用与挑战Application and Challenges of Artificial Intelligence in Drug Discovery[J]. 2021. [92] Frontiers. The efficacy of herbal medicines on the length of stay and negative conversion time/rate outcomes in patients with COVID-19: a systematic review[J]. 2024, 12. [93] 护理研究. 心肌梗死患者健康促进行为测评问卷的构建与评价[J]. 2022, 36(9): 1701-1705. [94] 中国抗癌协会. 2023中国整合肿瘤学大会论文摘要汇编[C]. 2023. [95] S4ME. Review - Potential of Phytomedicine in Benefiting Both Long COVID and Acute Coronary Syndromes: A State-of-the-art Review 2025 Jiang[EB/OL]. (2025-01-01)[2024-07-26]. https://s4me.org/research/biomedical/1211-review-potential-of-phytomedicine-in-benefiting-both-long-covid-and-acute-coronary-syndromes-a-state-of-the-art-review-2025-jiang. [96] pubmed.ncbi.nlm.nih.gov. A Randomized, Double-Blinded, Placebo-Controlled Study of the Use of Traditional Chinese Medicine for Treating Patients With Mild/Moderate Chronic Obstructive Pulmonary Disease[J]. 2025. [97] Hantopic. Insomnia and Herbal Medicine: A Comprehensive Review of Current Evidence and Future Directions[J]. 2025. [98] PLOS One. Silymarin in non-cirrhotics with non-alcoholic steatohepatitis: A randomized, double-blind, placebo controlled trial[J]. 2019, 14(6): e0217626.