神经退行性疾病深度解析:从病理机制到再生医学的未来
字数
3885 字
阅读时间
15 分钟
1. 引言:全球性的健康挑战
1.1 定义与范畴
- 神经退行性疾病(Neurodegenerative Diseases, NDs)是一类以中枢神经系统特定神经元群进行性丧失为核心特征的异质性疾病,最终导致认知、运动或自主神经功能的持续性衰退¹。
- 主要疾病类型包括阿尔茨海默病(AD)、帕金森病(PD)、亨廷顿病(HD)和肌萎缩侧索硬化(ALS)等。
1.2 普遍性与社会影响
- 随着全球人口老龄化加剧,神经退行性疾病的发病率逐年攀升,已成为严峻的公共卫生挑战。
- 以AD为例,预计到2050年,仅在中国,患者数量就可能超过4000万,带来的经济负担预计高达17万亿元人民币,对家庭和社会照护体系构成巨大压力。
1.3 本文结构与核心论点
- 本文将系统性梳理神经退行性疾病的核心发病机理、预防预警策略、诊断技术、现有治疗方案以及再生医学等前沿研究进展。
- 核心论点:应对神经退行性疾病的未来,必须从单一的对症治疗转向一个整合了主动预防、精准诊断与再生修复的综合管理新模式。
2. 发病机理:多因素交织的复杂网络
神经退行性疾病的发生是遗传、环境与内在分子病变相互作用的结果,其病理过程复杂且环环相扣。
- 2.1 蛋白质错误折叠与聚集:核心病理环节
- 阿尔茨海默病 (AD):其两大病理标志为细胞外的β-淀粉样蛋白(Aβ)沉积形成的老年斑,以及细胞内的Tau蛋白过度磷酸化后异常聚集形成的神经原纤维缠结¹⁻²。
- 帕金森病 (PD):标志性病理特征是中脑黑质多巴胺能神经元内α-突触核蛋白(α-synuclein)异常聚集形成的路易小体²。
- 这些错误折叠的蛋白质聚集体具有“种子样”传播特性,可在脑内不同区域扩散,通过干扰突触功能、诱发氧化应激和炎症反应,最终导致神经元死亡³。
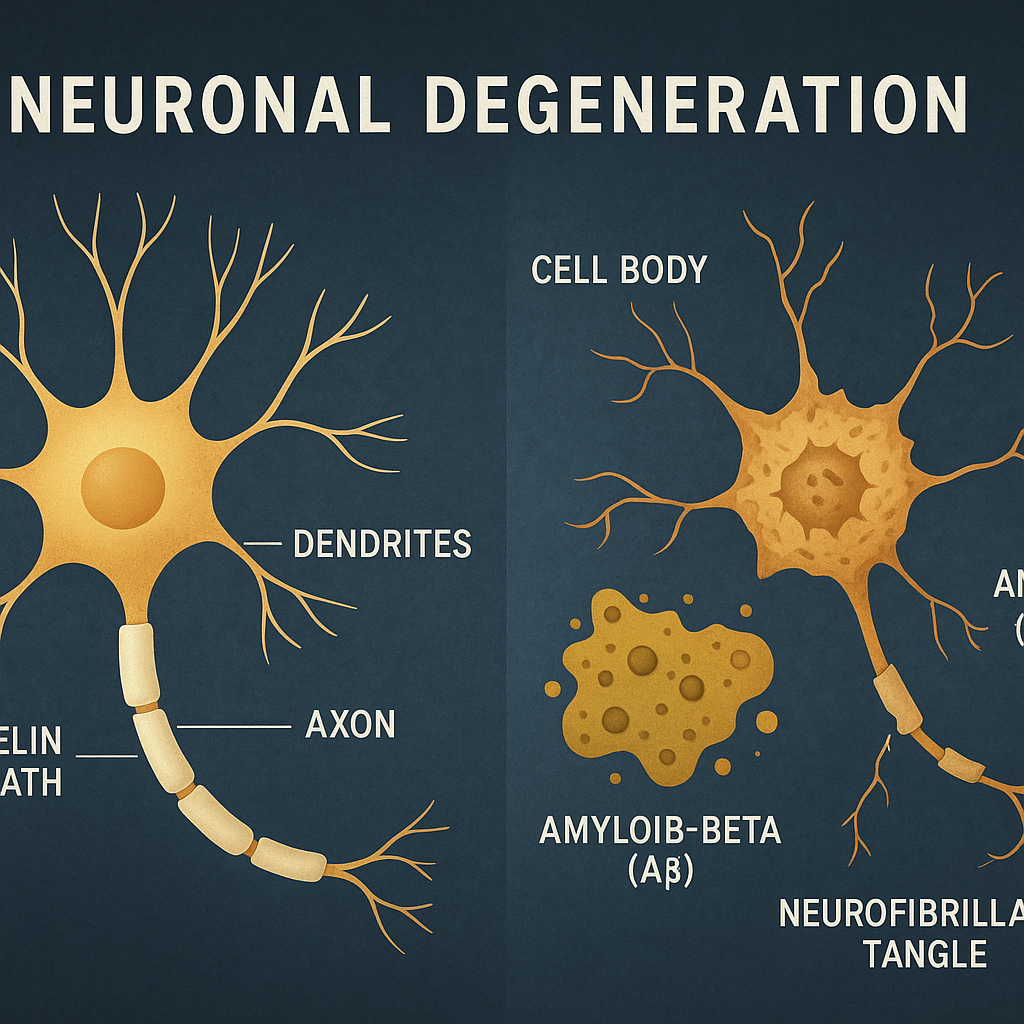 图1:神经元退化过程。 与左侧健康的神经元相比,右侧病变的神经元细胞体内出现神经原纤维缠结,细胞外则被Aβ斑块包围,导致其结构和功能受损,最终走向凋亡。
图1:神经元退化过程。 与左侧健康的神经元相比,右侧病变的神经元细胞体内出现神经原纤维缠结,细胞外则被Aβ斑块包围,导致其结构和功能受损,最终走向凋亡。
2.2 遗传与环境因素的协同作用
- 遗传易感性:遗传因素在AD发病风险中可占56-79%。早发性AD与
APP、PSEN1和PSEN2等基因的突变密切相关,而APOE4等位基因是散发性AD最强的遗传风险因子¹⁻²。对于PD,SNCA、LRRK2、GBA等基因突变是重要的致病因素²。 - 环境风险因素:头部外伤、高血压、糖尿病、农药(如百草枯)、重金属(如锰、铝)暴露以及空气污染等环境因素,可与遗传背景相互作用,显著增加发病风险²⁻⁴。
- 遗传易感性:遗传因素在AD发病风险中可占56-79%。早发性AD与
2.3 关键的细胞与分子机制
- 神经炎症:由蛋白聚集体激活的小胶质细胞和星形胶质细胞释放大量炎症因子,形成持续的慢性炎症环境,加剧神经元损伤¹。
- 线粒体功能障碍与氧化应激:线粒体是细胞的“能量工厂”,其功能障碍导致能量代谢紊乱和活性氧(ROS)过量产生,这是贯穿多种神经退行性疾病的共同损伤机制¹⁻²。
- 新兴机制:近年来,肠道微生物组失衡通过“肠道-脑轴”影响中枢神经系统健康,以及DNA甲基化等表观遗传学修饰,被认为是影响疾病发生发展的新兴研究方向³。
3. 预防与预警机制:主动干预与早期识别
鉴于目前尚无特效治愈方法,通过主动干预降低风险和早期识别信号至关重要。
3.1 有效的生活方式干预
- 饮食:地中海饮食模式,富含鱼类、蔬菜、坚果和橄榄油,被证实可将AD发病风险降低40%-60%⁵。
- 锻炼:规律的有氧运动能改善脑血管健康,促进神经发生,增强认知储备。
- 认知与社交活动:积极参与阅读、下棋、学习新技能及社交活动,有助于延缓认知功能下降。
- 慢性病管理:有效控制高血压、糖尿病、高血脂和肥胖等心血管风险因素是保护大脑健康的关键。
3.2 需要警惕的早期预警信号
- 阿尔茨海默病 (AD) 早期信号:
- 近期记忆力显著减退,反复询问或忘记刚发生的事。
- 语言障碍,出现找词困难。
- 在熟悉的地方迷路,空间和时间定向能力下降。
- 性格或情绪改变,如变得淡漠、多疑或易怒⁶。
- 帕金森病 (PD) 早期信号:
- 非运动症状(常先于运动症状出现):嗅觉减退、长期性便秘、快速眼动期睡眠行为障碍(如梦中大喊大叫、拳打脚踢)是极具提示性的早期信号⁷。
- 运动症状:静止性震颤(手部“搓丸样”抖动)、动作迟缓、肢体僵硬、“面具脸”(表情减少)、写字变小(小写症)⁷⁻⁸。
- 阿尔茨海默病 (AD) 早期信号:
4. 诊断与治疗方案现状:传统与现代技术的整合
4.1 现代诊断技术
- 脑影像学:
- PET成像:Aβ-PET和Tau-PET可分别实现对脑内Aβ斑块和Tau蛋白缠结的可视化和定量,为AD的早期和精准诊断提供关键病理证据⁹。
- MRI成像:用于评估特定脑区(如海马体)的萎缩程度和脑网络连接的改变。
- 生物标志物检测:
- 脑脊液 (CSF):检测Aβ42/Aβ40比值、总Tau蛋白(t-tau)和磷酸化Tau蛋白(p-tau)水平,是目前诊断AD的“金标准”之一。研究表明,CSF Aβ42/p-tau比值在早期诊断中具有极高的准确性⁹。
- 血液检测:作为一种微创、便捷的筛查手段,近年来发展迅速。血浆p-tau(尤其是p-tau181和p-tau217)和神经丝轻链(NfL)等新兴标志物,在区分AD与其他神经退行性疾病、监测疾病进展方面展现出巨大潜力¹⁰。
- 脑影像学:
4.2 现有治疗方案
- 药物治疗:目前主要以缓解症状为主,如用于PD的左旋多巴和用于AD的胆碱酯酶抑制剂,但无法阻止或逆转疾病的根本病理进程。
- 非药物疗法:物理治疗、职业治疗、言语训练和认知康复等,旨在维持患者功能,提高生活质量。
5. 前沿理论与实践研究:迈向再生医学
面对传统疗法的局限,再生医学为修复受损的神经系统带来了新的曙光。
- 5.1 干细胞疗法:从细胞替代到旁分泌修复
- 核心机制转变:早期研究聚焦于利用干细胞(如间充质干细胞MSCs)分化为新神经元来“替换”死亡细胞。然而,当前共识认为,其主要疗效源于旁分泌效应——即干细胞分泌多种生物活性分子,改善神经微环境,保护并修复内源性神经元。
- 面临挑战:直接移植活细胞面临存活率低、免疫排斥、潜在致瘤风险以及难以有效穿越血脑屏障(BBB)等重大障碍。
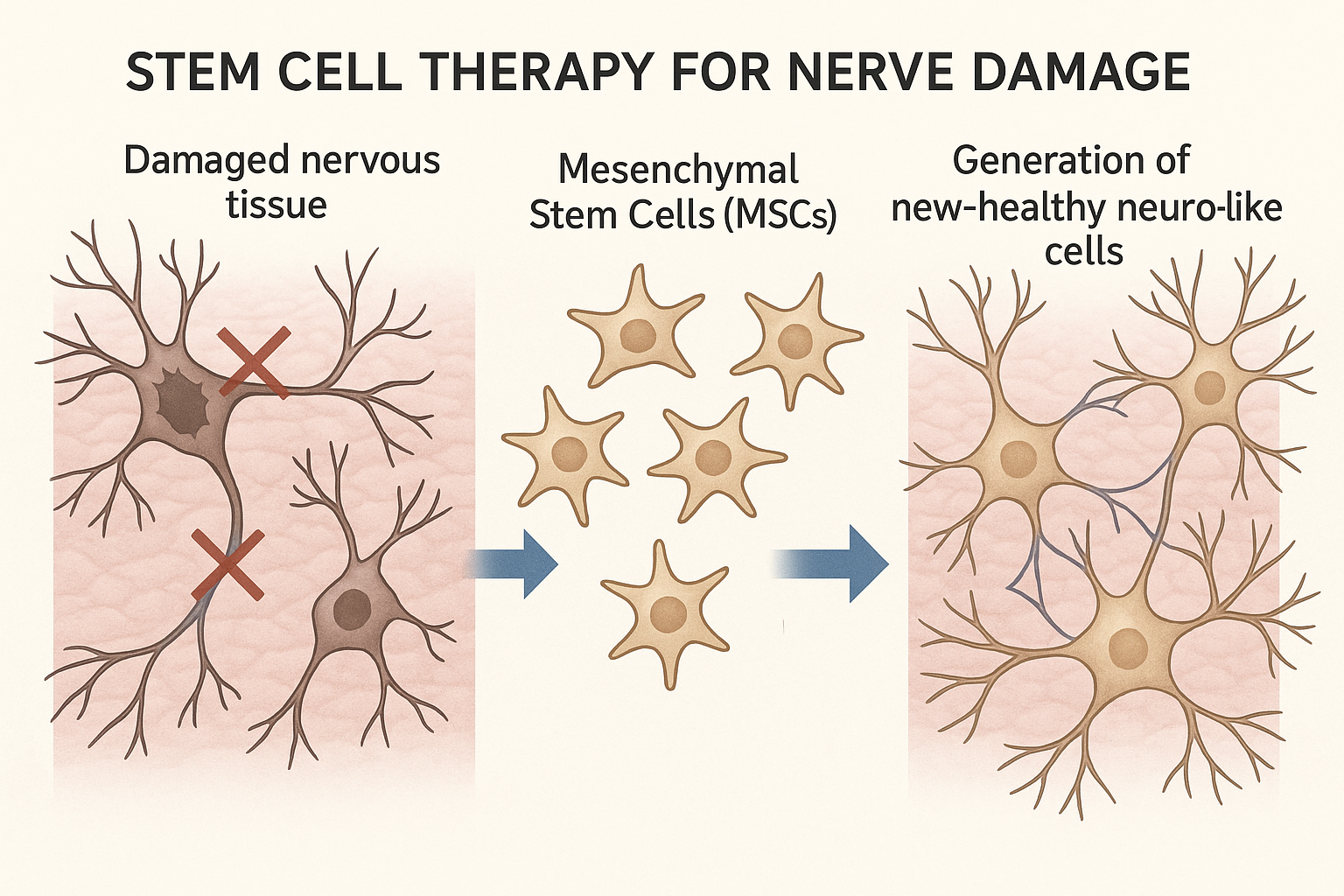 图2:干细胞疗法机制。 间充质干细胞(MSCs)被引入受损的神经组织后,通过分泌神经营养因子、抗炎因子等(旁分泌效应),创造一个有利于修复的微环境,从而保护现有神经元并促进其功能恢复。
图2:干细胞疗法机制。 间充质干细胞(MSCs)被引入受损的神经组织后,通过分泌神经营养因子、抗炎因子等(旁分泌效应),创造一个有利于修复的微环境,从而保护现有神经元并促进其功能恢复。
- 5.2 外泌体无细胞疗法:精准靶向的新希望
- 定义与优势:外泌体(Exosomes)是干细胞分泌的纳米级囊泡,其内部包裹了母细胞的治疗性物质(如蛋白质、miRNA等)。作为一种**“无细胞”疗法**,它继承了干细胞的修复潜力,同时根本性地克服了直接使用活细胞的安全性风险(无增殖能力)和免疫排斥问题。
- 作用机制:外泌体是天然的“纳米药物载体”,其独特的膜结构使其能够有效穿越血脑屏障,将内部的抗炎、抗凋亡和促进神经再生的生物活性分子精准递送至大脑病灶区域,发挥多靶点治疗作用。
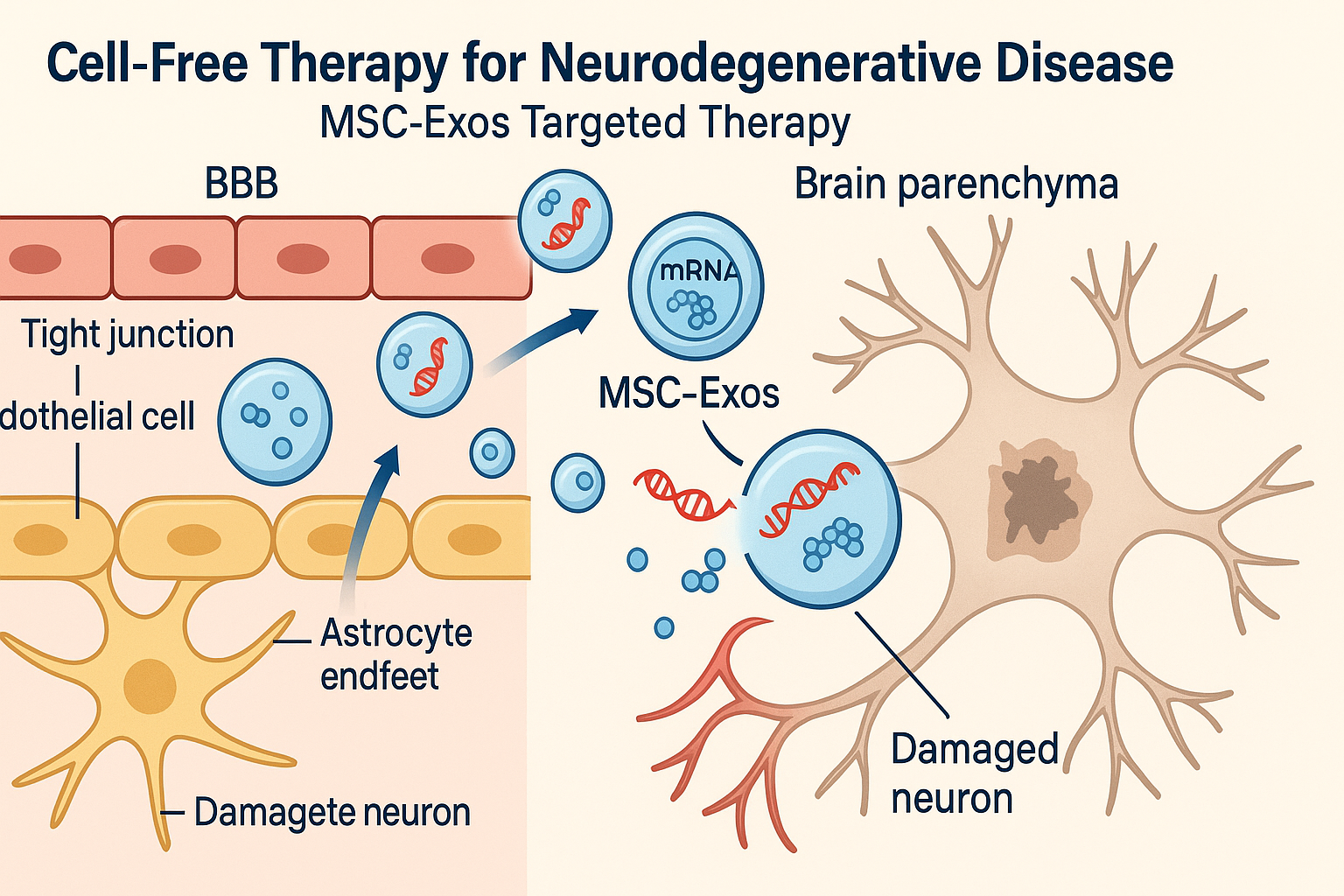 图3:外泌体靶向递送机制。 MSC来源的外泌体(MSC-Exos)能够穿过由内皮细胞和星形胶质细胞足突构成的血脑屏障(BBB),与受损的神经元融合,并释放其内部的mRNA、蛋白质等治疗性分子,从而发挥修复作用。
图3:外泌体靶向递送机制。 MSC来源的外泌体(MSC-Exos)能够穿过由内皮细胞和星形胶质细胞足突构成的血脑屏障(BBB),与受损的神经元融合,并释放其内部的mRNA、蛋白质等治疗性分子,从而发挥修复作用。
6. 经典案例分析:疾病的多维度影响
6.1 对患者的影响
- 一个典型的AD患者病程可能是从轻微的健忘和迷路开始,逐步发展为语言能力丧失、无法完成日常活动,最终完全依赖他人照护,严重剥夺了患者的尊严和生活质量¹¹。
6.2 对家庭的影响
- 真实案例显示,照护者往往需要承担巨大的身心压力和经济负担。家庭成员需轮流昼夜照护,原有的生活节奏被彻底打乱,许多照护者自身也出现严重的健康问题,如体重下降和抑郁¹¹。
6.3 对社会的影响
- 神经退行性疾病的高致残率和长病程,给社会医疗保险和养老服务体系带来了沉重负担。推广“黄手环”等防走失公益项目、建立社区脑健康筛查与管理体系,对于构建社会支持网络至关重要。
7. 治疗领域的创新空间与未来趋势
7.1 精准医疗的实现路径
- 未来,基于血液和脑脊液生物标志物的精准分型将成为可能,为患者选择最合适的靶向药物或再生疗法提供依据。
7.2 技术挑战与解决方案
- 再生医学的挑战:外泌体疗法等面临标准化生产、质量控制和靶向递送效率提升等挑战。通过基因工程改造外泌体表面,有望实现更精准的“导航”。
- 数字健康的应用:利用智能手机和可穿戴设备监测步态、打字速度和言语模式等,有望实现对疾病风险的超早期筛查和对病程的无创、连续监测¹²。
7.3 未来研究方向
- 深入探索肠道-脑轴、基因编辑技术(如CRISPR)以及新型抗体药物在神经退行性疾病治疗中的应用潜力,将是未来研究的重点。
8. 结论:迈向整合与再生的新纪元
8.1 核心观点总结
- 神经退行性疾病是遗传、环境与生活方式共同作用的复杂疾病,其核心病理在于蛋白质的异常聚集和由此引发的一系列级联损伤反应。
8.2 范式转变的展望
- 未来的治疗策略正在发生深刻的范式转变:从过去单一的对症治疗,迈向一个集积极预防、超早期诊断、多靶点干预和再生修复于一体的、贯穿全生命周期的综合管理新模式。
8.3 终极目标
- 随着科学的进步,特别是再生医学和精准诊断技术的发展,人类对抗神经退行性疾病的目标已不再局限于延缓病程,而是朝着阻止甚至逆转神经退行这一终极目标迈进。这需要科研、临床、产业和社会各界的共同努力。
参考文献
- CST 博客. (n.d.). 什么是神经退行性疾病?
- HUABIO. (n.d.). 只知道老年痴呆和帕金森?HUABIO带你了解真实的神经退行性疾病!
- De Strooper, B., & Karran, E. (2016). The Cellular Phase of Alzheimer's Disease. Cell, 164(4), 603-615.
- Cannon, J. R., & Greenamyre, J. T. (2011). The role of environmental exposures in neurodegeneration and neurodegenerative diseases. Toxicological Sciences, 124(2), 225-250.
- UCLA Health. (n.d.). 预防阿尔茨海默病的秘诀:拥有健康生活与心态.
- Sohu.com. (n.d.). 神经内科常见疾病的早期预警信号.
- Jfdaily.com. (n.d.). 如何识别早期帕金森病预警信号?来看专家介绍.
- 华商网. (n.d.). 留意帕金森病早期预警信号出现这些细节及时就医.
- Leuzy, A., et al. (2015). Detailed comparison of amyloid PET and CSF biomarkers for identifying early Alzheimer's disease. Journal of Nuclear Medicine, 56(9), 1350-1355.
- Zetterberg, H., & Blennow, K. (2021). Blood biomarkers for Alzheimer's disease — an update. Molecular Neurodegeneration, 16(1), 1-13.
- 福建省卫生健康委员会. (2024). 守护“被困在时间里的人”.
- 续航教育. (n.d.). 智能手机在神经退行性疾病早期识别中的应用与未来展望.